Die deutsche Biotechnologie-Branche 2012
Die Biotechnologie ist für viele Wirtschaftszweige zu einem wesentlichen Innovationstreiber geworden. 2011 hat die Branche in Deutschland erneut zugelegt - sowohl was den Umsatz, die Zahl der Mitarbeiter und die Zahl der Unternehmen angeht. Dies belegen die Ergebnisse der Biotechnologie-Firmenumfrage 2012, die biotechnologie.de im Auftrag des Bundesministeriums für Bildung und Forschung durchgeführt hat. Außerordentlich schwierig war es indes für die meisten Biotechnologie-Unternehmen, ihre Finanzierung sicherzustellen. Mit 142 Millionen Euro wurde von privater Seite nur wenig Kapital in die Branche investiert.
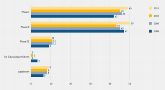
Klinische Pipeline
Die Pipeline ist das Rückgrat eines medizinischen Biotechnologieunternehmens. In der Pipeline kristallisiert Forschung zu Wirkstoffen, die – im Falle einer Zulassung – das Unternehmen in die Zukunft tragen werden. Deutsche Biotechnologie-Unternehmen haben auch in finanziell schwierigen Zeiten darauf geachtet, dass die Pipeline gefüllt bleibt. 2011 ist sie nun sogar deutlich gewachsen.
Insgesamt befanden sich im vergangenen Jahr 109 biologisch aktive Substanzen in einer der drei Phasen der klinischen Entwicklung (2010: 100). Dabei wurden 99 Kandidaten in einer der früheren Phasen I und II getestet, weitere zehn Präparate hatten das Finale in Phase III erreicht.
Zehn Kandidaten in klinischer Phase III
Die Produktkandidaten zählen innerhalb dieser Statistik jeweils nur einmal, auch wenn Zulassungen in mehreren Märkten angestrebt oder Studien in mehreren Indikationen durchgeführt werden. Zudem wurden nur Projekte aufgenommen, bei denen ein großer Teil der Entwicklungsarbeiten von deutschen Firmen durchgeführt wird. Deshalb wird ein Teil der Pipeline von ausländischen Firmen, die in Deutschland nur eine Niederlassung betreiben, nicht aufgeführt. Andersherum werden Kandidaten von Unternehmen mitgerechnet, die zwar auf dem Papier im Ausland beheimatet sind, deren zentrale Forschung und Entwicklung für ein Produkt aber hier in Deutschland stattfindet.
EU-Zulassung für Haut-Medikament
Die Krönung jeder Entwicklung ist die Marktzulassung eines Medikamentes. Nach mehreren Jahren der Flaute war 2011 wieder ein Neuzugang zu verzeichnen: Biofrontera erhielt die EU-Zulassung für Ameluz, das unter dem Namen BF-200 ALA entwickelt wurde, und steigerte die Zahl der deutschen Biotech-Medikamente am Markt auf neun. Ameluz soll Patienten mit aktinischer Keratose helfen, einer Vorstufe zu Hautkrebs. Der Wirkstoff 5-Aminolävulinsäure wird in Form einer gelartigen Nanoemulsion oberflächlich auf die betroffenen Stellen der Haut aufgetragen und mit Licht bestrahlt.
Einige der derzeit zehn Präparate im fortgeschrittensten Teil der Pipeline, der klinischen Phase III, könnten Ameluz bald folgen. Aussichtsreich ist zum Beispiel Rencarex, ein Medikament gegen das Nierenzellkarzinom, entwickelt von der Biotech-Firma Wilex aus München. Ende 2012 wird das Endergebnis der Studie mit mehr als 800 Patienten erwartet.
Auch Rückschläge
Die deutsche Pipeline wächst also wieder, doch gab es 2011 auch Rückschläge zu verzeichnen. Curacyte, ebenfalls in München beheimatet, musste 2011 eine Phase III-Studie mit dem Kandidaten Hemoximer vorzeitig abbrechen. In der Studie wurden 300 Patienten behandelt, die an distributivem Schock litten und bei denen die Standardbehandlung nicht anschlug. Das Präparat sollte nun die durch den Schock erweiterten Gefäße wieder verengen und so den Blutdruck der Erkrankten stabilisieren. Eine geplante Zwischenanalyse durch eine unabhängige Kommission ergab jedoch, dass die Behandlung keinen Überlebensvorteil ergab und sogar mit einigen zusätzlichen Komplikationen in Verbindung gebracht werden könnte. Selbst in den fortgeschrittenen Stufen der Entwicklung ist das Risiko für die Biotech-Unternehmen groß. Das einzige Mittel dagegen ist simpel, jedoch nicht einfach zu erreichen: eine gut gefüllte Pipeline.