Glykobiotechnologie im Aufwind: Gute Nachrichten für deutsche Unternehmen
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
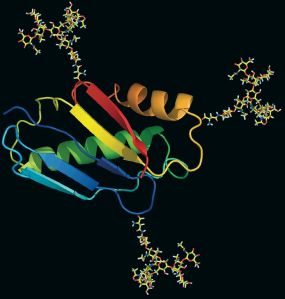
- Ein Eiweiß mit angehängten Zuckerstrukturen. Quelle: Glykostrukturfabrik
Ein gutes Dutzend deutscher Biotech-Unternehmen hat sich der Zuckerforschung verschrieben und setzt darauf, dass sich glykobiologische Ansätze langfristig auch wirtschaftlich auszahlen. Immerhin hat sich der Schweizer Pharmakonzern Roche die Übernahme der ebenfalls in der Schweiz ansässigen Biotech-Firma Glycart Biotechnology 143 Millionen Euro kosten lassen und die US-Merck legte für eine Allianz mit dem US-Unternehmen GlycoFi 295 Millionen Euro auf den Tisch. Beide Transaktionen gingen im Jahr 2005 über die Bühne, seitdem war es vergleichsweise ruhig bestellt um die Glykobiotechnologie. Doch nun scheint der deutsche Markt in Bewegung zu kommen, wie zwei Nachrichten aus dem Oktober beweisen: Die ehemaligen Hexal-Gründer Thomas und Andreas Strüngmann haben 40 Millionen Euro in die auf Glykodesign spezialisierte Firma Glycotope in Berlin investiert, um deren klinische Entwicklung voranzutreiben. Die Heilbronner greenovation GmbH wiederum hat für den Aufbau eines Photobioreaktors im Industriemaßstab zur Herstellung zuckeroptimierter Biotech-Medikamente in Moosen die Sartorius Stedim Biotech als Partner gewinnen können. Doch was verbirgt sich eigentlich hinter der Glykobiotechnologie? Das Themendossier gibt einen Einblick in die Welt der Zuckerforschung und deren Potenzial für die Zukunft.
Zuckerguss für maßgeschneiderte und passgenaue Arzneien
Der Anteil biotechnologisch hergestellter Medikamente hat in den vergangenen Jahren enorm zugenommen. Inzwischen sind mehr als 100 solcher Arzneien in Deutschland zugelassen. Damit nehmen Biotechnologie-Medikamente auch wirtschaftlich eine wichtige Rolle ein: Nach Angaben des Verbandes Forschender Arzneimittelhersteller (VFA) liegt ihr Anteil am Gesamtumsatz der Pharmaindustrie in Deutschland derzeit bei 12 Prozent.
Die Produktion von therapeutisch wirksamen Eiweißmolekülen erfolgt in speziell dafür entwickelten Bioreaktoren, die mit Mikroorganismen oder tierischen Zellen ausgestattet sind. Diese Zellen sind gentechnisch so umprogrammiert, dass sie biologisch aktive, für den Menschen maßgeschneiderte Eiweiße herstellen können. Lange Zeit wurden für diese Produktion Bakterien genutzt, zumeist das Darmbakterium Escherichia coli. Die genetische Ausstattung dieses Einzellers ist gut bekannt, er lässt sich relativ einfach in großen Mengen kultivieren und gezielt in der biotechnologischen Produktion einsetzen. Auf diese Weise entstehen heutzutage etwa Medikamente für Millionen von Patienten, die an der Zuckerkrankheit (Diabetes mellitus, Typ 1) leiden. Das für diese Therapie genutzte menschliche Insulin wird in Escherichia coli biotechnologisch hergestellt. Darüber hinaus sind Produktionssysteme auf der Basis von Säugetierzellen für die biotechnologische Herstellung von therapeutischen Antikörpern im Einsatz.
Bakterielle Produktionssysteme stoßen an Grenzen
Die Nutzung von Bakterien stößt jedoch an Grenzen, denn bestimmte biochemische Reaktionen können diese Lebewesen nicht durchführen – so sind sie nicht in der Lage, an Eiweißmoleküle Zuckerbausteine anzuhängen. Dieser Prozess der Glykosylierung ist eukaryontischen Zellen vorbehalten, die über ein endoplasmatisches Retikulum (ER) und einen Golgi-Apparat verfügen. Da der Zuckercode von Eiweißen für immer mehr therapeutische Ansätze eine wichtige Rolle spielt, ist die Glykosylierung inzwischen auch in der Medikamentenproduktion ein wichtiges Thema, um Eiweiße mit einer ‚menschlichen‘, natürlichen Zuckerstruktur zu erhalten.
Auch Moose eignen sich zur Produktion glykosylierter therapeutischer Eiweiße. Quelle: greenovation Biotech GmbH
Innovative Produktionssysteme auf dem Prüfstand
Auf der Seite der Wissenschaft wird deshalb intensiv daran geforscht, neue oder optimierte Zellsysteme zu entwickeln, mit denen sich die Verzuckerung der therapeutischen Moleküle gezielt initiieren und steuern lässt. Viele Forschungsanstrengungen zielen dabei auf die Optimierung der Glykosylierungsprozesse in Säugetierzellen. Inzwischen gibt es aber auch Ansätze, pflanzliche Systeme wie Moose für die Produktion therapeutischer Eiweiße einzusetzen.
Bei Glykoproteinen werden die Zuckeranteile Schritt für Schritt aufgebaut. Dies geschieht unter Mithilfe einer ganzen Glykosylierungsmaschinerie. Bisher konnten rund 200 Enzyme identifiziert werden, die daran beteiligt sind. Für jedes Eiweiß, das über einen bestimmten Synthesepfad gebildet wird, stehen im Prinzip die gleichen Werkzeuge zur Verfügung. Dennoch kommt es zu Unterschieden in den Glykosylierungsmustern. Diese qualitativen und quantitativen Unterschiede bei der Glykosylierung von Eiweißen werden durch die Spezies und das Gewebe, in dem das Glykoprotein gebildet werden, sowie den physiologischen Zustand (Stoffwechsel, Ernährung) bestimmt. Menschen, denen die genetische Ausstattung zur Umsetzung der Glykosylierung fehlt, leiden unter schweren Organschäden und mentalen Störungen. Ihre Lebenserwartung ist meist nicht sehr hoch. Dies unterstreicht, dass Glykosylierungsprozesse für die Entwicklung des Menschen von enormer Bedeutung sind.
Glykodesigner ändern Zellen nach Maß
Die verschiedenen Einflussfaktoren der Glykosylierung werden nun auch bei der Produktion therapeutischer Eiweiße ausgenutzt. Über die Zellart, deren Entwicklungsstadium und die Zellkulturbedingungen lässt sich die Verzuckerung gezielt verändern und auf genetischer Ebene beeinflussen. Die Zellsysteme, an denen dabei gearbeitet wird, reichen von Säugetierzellen über Pilze bis hin zu Moosen, die jeweils für die biotechnologische Nutzung maßgeschneidert werden müssen (Glykodesign). Welches Expressionssystem schließlich zum Einsatz kommt, ist von der Art des therapeutischen Eiweißes abhängig, das produziert werden soll und immer auch eine Kostenentscheidung. Neue Verfahren – wie beispielsweise die Nutzung von Moosen – bieten Kostenvorteile, haben aber auch den Nachteil zunächst überhaupt ersteinmal industriell etabliert zu sein. Langfristig gehen Experten davon aus, dass mehrere Produktionssysteme parallel existieren werden.
Für biopharmazeutische Produzenten ist Glykodesign ein wichtiges Thema.
Ziel eines solchen Glykodesigns – ob mit tierischen oder pflanzlichen Zellen – ist es zum Beispiel, die Aktivität der Eiweiße zu erhöhen oder deren Halbwertzeit zu verlängern, damit sie vom Körper nicht so schnell abgebaut werden. Auf diese Weise werden sowohl bestehende Medikamente optimiert, als auch neue Arzneien von Anfang an gezielt auf maximale Wirksamkeit bei möglichst niedrigen Dosen ‚getrimmt’.
Ein prominentes Beispiel ist das blutbildende Erythropoetin (EPO), das zur Behandlung von Patienten mit chronischem Nierenversagen oder Blutarmut eingesetzt wird. Mit Hilfe biotechnologischer Verfahren wird humanes EPO seit den 90er Jahren in Bioreaktoren hergestellt. EPO ist ein Glykoprotein mit insgesamt vier Glykosylierungsstellen und so wurde es lange Zeit auch produziert. EPO-Mittel der zweiten Generation verfügen nun jedoch über zwei weitere, zusätzlich angefügte Glykosylierungsstellen, wodurch das Hormon erst viel später durch einen spezifischen Rezeptor in der Leber erkannt und abgebaut wird. Damit müssen Patienten ihr Medikament nur noch einmal pro Woche einnehmen, was eine erhebliche Therapieerleichterung darstellt.
Andere Anstrengungen zielen darauf ab, die Effektivität von sogenannten monoklonalen Antikörpern in der Krebstherapie zu erhöhen. Dafür werden diese therapeutischen Eiweiße gezielt so verändert, dass sie etwa Immunzellen anlocken. Eine solche Steigerung der sogenannten Antikörper abhängigen zellulären Toxitität (ADCC) wird von vielen Glykodesignern verfolgt. Dies bietet Arzneimittelentwicklern sowohl Verbesserungspotenzial für bestehende Krebsmedikamente (mit dem Vorteil eines möglichen neuen Patentschutzes oder Indikationserweiterung) als auch Effizienzsteigerungen bei Neuentwicklungen.




