Glykobiotechnologie im Aufwind: Gute Nachrichten für deutsche Unternehmen
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
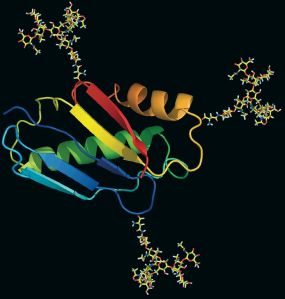
- Ein Eiweiß mit angehängten Zuckerstrukturen. Quelle: Glykostrukturfabrik
Ein gutes Dutzend deutscher Biotech-Unternehmen hat sich der Zuckerforschung verschrieben und setzt darauf, dass sich glykobiologische Ansätze langfristig auch wirtschaftlich auszahlen. Immerhin hat sich der Schweizer Pharmakonzern Roche die Übernahme der ebenfalls in der Schweiz ansässigen Biotech-Firma Glycart Biotechnology 143 Millionen Euro kosten lassen und die US-Merck legte für eine Allianz mit dem US-Unternehmen GlycoFi 295 Millionen Euro auf den Tisch. Beide Transaktionen gingen im Jahr 2005 über die Bühne, seitdem war es vergleichsweise ruhig bestellt um die Glykobiotechnologie. Doch nun scheint der deutsche Markt in Bewegung zu kommen, wie zwei Nachrichten aus dem Oktober beweisen: Die ehemaligen Hexal-Gründer Thomas und Andreas Strüngmann haben 40 Millionen Euro in die auf Glykodesign spezialisierte Firma Glycotope in Berlin investiert, um deren klinische Entwicklung voranzutreiben. Die Heilbronner greenovation GmbH wiederum hat für den Aufbau eines Photobioreaktors im Industriemaßstab zur Herstellung zuckeroptimierter Biotech-Medikamente in Moosen die Sartorius Stedim Biotech als Partner gewinnen können. Doch was verbirgt sich eigentlich hinter der Glykobiotechnologie? Das Themendossier gibt einen Einblick in die Welt der Zuckerforschung und deren Potenzial für die Zukunft.
Zucker sind nicht nur süß: Eine Einführung
Hinter dem Begriff Zucker, den wir normalerweise verwenden, verbirgt sich für Wissenschaftler die Welt der Kohlenhydrate – für die sich Chemiker, Biologen, Biochemiker, aber auch Mediziner und Physiker interessieren. Kohlenhydrate sind noch vor den Eiweißen und Nukleinsäuren die größte Substanzklasse innerhalb der Biomoleküle. Sie stellen als energieliefernde Zucker (Traubenzucker, Milchzucker) sowie als Ballaststoffe (Pektin, Zellulose) einen großen Anteil in unserer Nahrung dar, spielen als Stützsubstanz (Zellulose, Chitin) im Pflanzen- und Tierreich eine wichtige Rolle und übernehmen wichtige Funktionen als Energiespeicher (Stärke). Zudem sind Kohlenhydrate Bestandteil des Grundgerüsts von Erbmolekülen, den Hauptinformationsträgern in der Natur. Darüber hinaus haben Kohlenhydrate in lebenden Organismen viele zentrale Aufgaben – insbesondere im Zusammenspiel mit Eiweißen (Proteinen).
Zucker geben Eiweißen ihren Charakter
Die Eiweißmoleküle sind die Arbeitstiere in lebenden Organismen, jede Körperzelle des Menschen enthält Tausende unterschiedliche von ihnen. Die Zuckerstrukturen geben all diesen unterschiedlichen Eiweißen zusätzlich eine persönliche Ausprägung bzw. Charakter und modulieren deren Funktionen oder ergänzen sie mit weiteren unterschiedlichsten Funktionen. Hängen die Zucker beispielsweise an Eiweißmolekülen auf der Oberfläche von Zellen, dann dienen sie als Antennen. Damit können Zellen sowohl Informationen empfangen und ins Innere weiterleiten als auch Signale aus dem Zellinneren an benachbarte Zellen oder vorbeitreibende Eiweiße weitergeben. Für im Blutstrom schwimmende Zellen können angehängte Zuckerketten aber auch als eine Art Anker dienen, um sich an einen bestimmten Ort anzuheften und in das entsprechende Gewebe einzuwandern. Darüber hinaus haben Zuckermoleküle auch einen Einfluss auf biophysikalische Funktionen und bestimmen unter anderem die Dauer der Aktivität von Eiweiß-molekülen, an denen sie hängen.
Griechische Namensgebung
Wenn sich Wissenschaftler mit der Rolle von Zuckerstrukturen beschäftigen, dann wird dies Glykobiologie genannt – abgeleitet vom griechischen Wort „glykós“ für „süß“. Die Gesamtheit aller Zuckerstrukturen im Organismus wird als Glykom bezeichnet. Daran angelehnt findet sich inzwischen auch der häufig im Englischen benutzte Begriff Glycomics als Gesamtbezeichnung für dieses Forschungsfeld.
In der Stoffklasse der Kohlenhydrate wird zwischen Einfachzuckern (Monosaccharide), Zweifachzuckern (Disaccharide), Mehrfachzuckern (Oligosaccharide) und Vielfachzuckern (Polysaccharide) unterschieden. Letztere sind die komplexesten Zuckermoleküle und werden häufig auch als Glykane bezeichnet. Bestehen Moleküle aus Zuckerstrukturen und anderen Komponenten, spricht man von Glykokonjugaten. Mit Zuckerstrukturen behangene Eiweißmoleküle werden Glykoproteine genannt, Fettmoleküle mit angehefteten Zuckerbausteinen nennen sich in der Fachsprache Glykolipide. Darüber hinaus gibt es Moleküle, die zielgerichtet Zuckerbausteine erkennen und über eine Bindung biochemische Reaktionen auslösen können. Dazu gehören die Antikörper als Teil der körpereigenen Immunabwehr, aber auch Enzyme oder als Lektine bezeichnete Rezeptormoleküle.
Unendlich große Strukturvielfalt
Aufgebaut sind die Zuckermoleküle oft aus mehreren ringförmigen Bausteinen (Einfachzuckern). Diese können sich in ihrer Abfolge, in der Art der Verknüpfung, der Kettenlänge und dem Verzweigungsgrad voneinander unterscheiden – und bilden damit die Grundlage für die große Strukturvielfalt der Zucker. Während der handelsübliche Haushaltszucker (Saccharose) beispielsweise nur aus zwei ringartigen Bausteinen zusammengesetzt ist, sind biologisch aktive Zucker im Körper weitaus komplexer. Werden etwa nur drei Einfachzucker kombiniert, sind bereits mehr als 27.000 verschiedene Strukturen denkbar – die wiederum alle ganz unterschiedliche biologische Aufgaben im lebenden Organismus erfüllen könnten. Allerdings zeigen Analysen, dass die Natur nur einen Teil der theoretisch möglichen Strukturen produziert.
Sehr häufig sind Verknüpfungen mit anderen Molekülen – wie Eiweiße oder Fette. Aufgrund ihrer biologischen Bedeutung für die Forschung sind diese Glykokonjugate von besonderem Interesse. In der Fachsprache wird auch davon gesprochen, dass Eiweiße glykosyliert sind. So kann es sein, dass an ein und demselben Eiweißmolekül ganz verschiedene Zuckerbausteine hängen – und diese viele verschiedene Eigenschaften, Aufgaben und Funktionen des Eiweißmoleküls bestimmen und dazu beitragen, dass auch ein Eiweiß nicht gleich ein Eiweiß ist. Inzwischen ist bekannt, dass mehr als die Hälfte der Eiweiße und Fette im menschlichen Körper im Laufe ihres Herstellungsprozesses, ihres zellulären Transportes oder ihrer Funktionsausübung mit Zuckermolekülen ausgestattet sind – angehängte Zuckerketten sind maßgeblich für den individuellen Charakter der Eiweiß- und Fettmoleküle verantwortlich. Um Ordnung in diesem Dickicht an möglichen strukturellen Varianten zu schaffen, beschäftigen sich viele Glykobiologen ausschließlich mit detaillierten Strukturanalysen von Zuckerkomplexen, die dank der Entwicklung von Hochdurchsatzverfahren immer bessere Einsichten ermöglichen.
Kleine Fortschritte: Entwicklung der Glykobiologie
Die Vielfalt und Komplexität der Zuckerstrukturen ist ein Grund dafür, dass sich die Wissenschaft lange Zeit eher auf die Analyse von Genen und Eiweißen als Träger biologischer Informationen und Funktionen konzentriert hat. Daraus resultierte bis in die 90er Jahre hinein nur ein rudimentäres Wissen um die tatsächlichen Aufgaben der Zuckerstrukturen im menschlichen Körper, beispielsweise bei der Entstehung von Krankheiten. Nur eine vergleichsweise kleine Gruppe von Chemikern und Biochemikern beschäftigte sich mit den komplexen Gebilden und maß den Zuckern überhaupt eine Beteiligung an krankheitsrelevanten Prozessen zu. Die Mehrheit der Wissenschaftler konzentrierte sich bei der Suche nach Ursachen auf das Erbgut, was durch die technischen Weiterentwicklungen auf dem Gebiet der Genomsequenzierung noch vorangetrieben wurde. Aus diesem Grund stand die Glykobiologie lange im Schatten der Genom- und Proteomforschung.
| Forscherprofil: Die künstliche Herstellung von Zuckermolekülen ist für Glykobiologen unerlässlich. Früher waren dafür Monate nötig. Inzwischen hat Peter Seeberger einen Roboter für diese Arbeit entwickelt. Mehr |
Im Laufe der vergangenen Jahre hat sich das Blatt allerdings gewendet. Die essentielle Rolle der Zuckerstrukturen wird immer besser verstanden. Seit im Jahr 2003 die vollständige Entschlüsselung des menschlichen Genoms gelang, erkannten die Forscher, dass es nicht nur viel mehr Eiweißmoleküle als Gene, sondern darüber hinaus auch noch viel mehr Zuckermoleküle als Eiweiße gibt. Nun wächst langsam die Bereitschaft, sich intensiver mit der Rolle der Zuckerstrukturen auseinanderzusetzen und ihr auch von wissenschaftlicher Seite einen größeren Stellenwert einzuräumen. Im Jahr 2003 stufte das Wissenschaftsmagazin des Massachusetts Institute of Technology (MIT) die Erforschung der Zuckerstrukturen im menschlichen Organismus sogar als eine von zehn Spitzentechnologien der Zukunft ein.
Neuer Impuls durch Techniksprung
Ähnlich wie bei der Entschlüsslung des Genoms, die ohne eine entsprechende Sequenziertechnik kaum denkbar gewesen wäre, kam aber auch für die Glykobiologie ein entscheidender Impuls von technischer Seite – dieser machte die sprunghaften Erkenntnisfortschritte der vergangenen Jahre überhaupt erst möglich.
Der komplexe, oft sehr vielfältig verzweigte Aufbau der Zuckerstrukturen ließ die Wissenschaftler nämlich lange verzweifeln: Um diese Moleküle künstlich herzustellen, waren mitunter monatelange, langwierige und mühsame Prozesse nötig. Eine solche Synthese, wie der Herstellungsprozess in der Fachwelt genannt wird, ist allerdings für eine eingehende Analyse im Labor unerlässlich, um einzelne Funktionen, Aufgaben sowie Strukturen auf molekularer Ebene zu entschlüsseln.
Zuckermoleküle sind sehr komplex: Ganz rechts ist ein Eiweiß mit angehängten verzweigten Zuckerketten zu sehen, in der Mitte ein 'reines' Eiweißmoleküle und ganz links das Erbmolekül DNA. Quelle: Glykostrukturfabrik/Berlin
Zucker aus natürlichen Quellen zu isolieren ist sehr schwierig, da die Moleküle nur in geringen Mengen vorliegen. Die chemische Herstellung ist daher die einzige Alternative, wenn auch eine knifflige. Solange es keine technische Möglichkeit gab, Zuckermoleküle möglichst einfach und schnell sowie in großer Masse und guter Qualität künstlich herzustellen, ging der Erkenntnisfortschritt nur in Trippelschritten voran. Ende der 90er Jahre entwickelte der deutsche Wissenschaftler und Chemiker Peter Seeberger, heute Professor an der Eidgenössischen Technischen Hochschule (ETH) in Zürich, einen Syntheseroboter, der die künstliche Herstellung der hoch komplexen Zuckermoleküle 500mal schneller als vorher ermöglichte. Früher war eine Doktorarbeit erforderlich, um einen Zucker künstlich herzustellen. Mit dem Roboter ist die Zuckersynthese inzwischen eine Sache von ungefähr 24 Stunden.
Mit dem automatischen Synthesewerkzeug revolutionierten Seeberger und seine Kollegen die Glyko-Forschungswelt. Hinzu kam der technische Fortschritt in der Glykoanalytik, um die strukturelle Vielfalt der Zucker besser zu verstehen. Dies hat erheblich dazu beigetragen, dass Zuckerverbindungen in vielen medizinisch relevanten Prozessen heutzutage eine wesentliche Rolle beigemessen wird.
Zuckerforschung in der Medizin: Bedeutung wächst
Im Fokus der Glykobiologen in der medizinischen Forschung stehen folgende Fragen:
• Wie beeinflussen Zuckerstrukturen die Eigenschaften von Eiweißmolekülen, an denen sie gebunden sind?
• Welche Rolle spielen Kohlenhydrate bei Erkennungsprozessen zwischen Zellen untereinander sowie zwischen Zellen und Eiweißen?
• Welche Prozesse finden bei diesen Zell-Zell- sowie Zell-Eiweiß-Interaktionen statt?
Diese gilt es bezogen auf krankheitsrelevante Prozesse aufzuklären – sei es bei der Suche nach der Ursache von Krankheiten, sei es bei der Feststellung, in welchem Entwicklungsstadium sich die Krankheit befindet. Da die Zellmembran fast ausschließlich aus Fett- und Eiweißmolekülen besteht und die meisten hiervon mit Zuckerketten versehen sind, ist fast jede Zelle im Körper in einen Zuckerpelz gehüllt. Im Falle von krankhaften Veränderungen können hier verräterische Hinweise entdeckt werden, die gezielt zur Entwicklung von Diagnose- oder Therapieverfahren genutzt werden könnten.
Zucker als Angriffspunkte für Therapien
Da die Zuckermoleküle im Körper hochspezialisiert sind, eignen sie sich auch ideal als Angriffspunkt für noch wirksamere und effektivere Medikamente – vor allem weil Krankheitserreger Zuckerstrukturen für sich ausnutzen. Das Wissen der Glykobiologen kann dazu beitragen, ganz neue diagnostische und therapeutische Wege bei der Behandlung verschiedenster Krankheiten zu beschreiten.
Zuckerguss für Medikamente
Darüber hinaus werden Zuckerstrukturen zielgerichtet bei der biotechnologischen Herstellung eiweißbasierter Medikamente genutzt – um sie passgenauer für den Menschen maßzuschneidern. Dafür werden die Produktionsstämme von Mikroorganismen oder tierische Zelllinien so optimiert, dass sie nicht nur passende Eiweißmoleküle herstellen, sondern ihnen gleichzeitig die passenden Zuckerketten anhängen. Mit dieser Art „Zuckerguss“, der Glykosylierung, lässt sich die biologische Aktivität von Medikamenten verbessern und ihre Wirksamkeit erhöhen. Viele Forscher in Deutschland arbeiten nun daran, entsprechende Produktionssysteme noch zu verfeinern sowie ganz neue maßgeschneiderte Zellen für die Arzneimittelherstellung im Labor zu designen.
Zucker als Basis für neue Diagnostika
Jede Zelle ist von einem charakteristischen Zuckerpelz umhüllt, dessen Struktur durch die Glykoproteine und Glykolipide in der Membran bestimmt wird. Die Zuckerreste der Eiweißmoleküle dienen dabei als äußere Andockstelle und haben somit einen entscheidenden Anteil an der zellulären Kommunikation. Eine Reihe von Molekülen ist nun in der Lage, diese Zuckerbausteine zu erkennen, daran zu binden und auf diese Weise eine biochemische Reaktion auszulösen. Dazu gehören die Antikörper als Teil der körpereigenen Immunabwehr, aber auch Enzyme oder als Lektine bezeichnete Rezeptormoleküle.
Die Bindung zwischen Zuckermolekülen und solchen Bindungspartnern erfolgt ähnlich einem Schlüssel-Schloss-Prinzip. Zuckermoleküle sind dabei oft sehr spezifisch – ähnlich wie Schlüssel, so dass sie nur für ganz bestimmte „Schlösser“ tatsächlich passen und eine Reaktion auslösen. Je nachdem, welche Funktion gefragt ist, sind Zellen aber auch in der Lage, ihre „Schlüssel“ – also ihre Zuckerstrukturen – den Gegebenheiten anzupassen. Auf diese Weise ändern sich die Zuckerstrukturen während der embryonalen Entwicklung des Menschen, aber auch bei Lernvorgängen im Gehirn. Ihre Vielfältigkeit und Wandlungsfähigkeit machen sich Zellen auch bei der Kommunikation zunutze. Dabei können die Zuckerbausteine mitunter als Antennen dienen, um Signale von außen nach innen oder von innen nach außen weiterzuleiten. In anderen Fällen werden sie als Anker zur Anheftung von Zellen benutzt, um sich in einem bestimmten Gewebe anzusiedeln und somit das Einwandern von Zellen in dieses Gewebe in Gang zu setzen.
Das Bild zeigt eine natürliche Killerzelle (gelb), die eine Krebszelle (rot) angreift. Quelle: Universitätsklinikum Tübingen.
Strukturanalyse dient Entwicklung innovative Diagnostika
Solche zellulären Kommunikationsprozesse spielen bei Krankheiten oft eine entscheidende Rolle. Inzwischen konnte gezeigt werden, dass viele krankhafte Zellen ein anderes Zuckermuster auf ihrer Oberfläche aufweisen als gesunde Zellen. Diese Veränderungen nutzen Glykobiologen inzwischen gezielt aus und suchen nach verräterischen Mustern im Zuckerpelz der Zellen oder nach einer vermehrten Produktion der jeweiligen Zucker-Bindungspartner. Auf diese Weise können Glykane als Biomarker für unterschiedliche Entwicklungsstufen eines Tumors dienen sowie bei der Bestimmung des Ausbreitungspotenzials helfen.
Um diese Biomarker zu erkennen, sind sehr genaue glyko-analytische Methoden notwendig – keine leichte Angelegenheit bei der Strukturvielfalt und Komplexität der Zuckermoleküle. Ein eigenes Feld der Glykoanalytik beschäftigt sich ausschließlich mit diesem Thema. Handelt es sich dabei um Glykoproteine, dann kann die Analyse entweder am intakten Molekül erfolgen oder es wird der Zuckerteil vom Rest des Eiweißes getrennt, um einen sogenannten Glykanpool zu gewinnen. Dies kann auf chemischem Weg oder enzymatisch geschehen. Da die Mengen oft nicht sehr groß sind, es aber mitunter sehr viele Zucker-Eiweiß-Verbindungen gibt, ist dieser Schritt sehr empfindlich und zeitintensiv.
| Mehr zum Thema auf biotechnologie.de |
Analyse von Zuckerstrukturen bei der Entwicklung des Neuroblastoms Neue Diagnostika und Therapeutika im Kampf gegen den schwarzen Hautkrebs |
Zur Analyse der Glykane werden Techniken aus der Chromatographie sowie der Massenspektrometrie genutzt, wie die Hochdruckflüssigkeitschromatographie (HPLC) oder die Matrix-assistierte Laserdesorption/Ionisations-Massenspektrometrie (MALDI-MS). Um die dreidimensionale Struktur von Eiweißen und Glykanen im Detail zu untersuchen, kommen wiederum Verfahren der Röntgenkristallographie und der Kernspinresonanzspektroskopie zur Anwendung. Mithilfe dieser Verfahren ist es für eine ganze Reihe von Krankheiten gelungen, spezifische Zuckermuster auf den betreffenden Zelloberflächen zu identifizieren und strukturell zu beschreiben – sei es für verschiedene Krebsarten, Infektionskrankheiten oder Entzündungen. Aufbauend auf diesen Analysen konzentrieren sich Wissenschaftler nun darauf, Diagnostika für eine Vielzahl von Anwendungsmöglichkeiten zu entwickeln. Dabei geht es beispielsweise um die Früherkennung von Krankheiten, der Suche nach dem ‚passenden‘ Therapeutikum für einen Patienten oder um die Kontrolle des Therapieverlaufes.
Zuckerguss für maßgeschneiderte und passgenaue Arzneien
Der Anteil biotechnologisch hergestellter Medikamente hat in den vergangenen Jahren enorm zugenommen. Inzwischen sind mehr als 100 solcher Arzneien in Deutschland zugelassen. Damit nehmen Biotechnologie-Medikamente auch wirtschaftlich eine wichtige Rolle ein: Nach Angaben des Verbandes Forschender Arzneimittelhersteller (VFA) liegt ihr Anteil am Gesamtumsatz der Pharmaindustrie in Deutschland derzeit bei 12 Prozent.
Die Produktion von therapeutisch wirksamen Eiweißmolekülen erfolgt in speziell dafür entwickelten Bioreaktoren, die mit Mikroorganismen oder tierischen Zellen ausgestattet sind. Diese Zellen sind gentechnisch so umprogrammiert, dass sie biologisch aktive, für den Menschen maßgeschneiderte Eiweiße herstellen können. Lange Zeit wurden für diese Produktion Bakterien genutzt, zumeist das Darmbakterium Escherichia coli. Die genetische Ausstattung dieses Einzellers ist gut bekannt, er lässt sich relativ einfach in großen Mengen kultivieren und gezielt in der biotechnologischen Produktion einsetzen. Auf diese Weise entstehen heutzutage etwa Medikamente für Millionen von Patienten, die an der Zuckerkrankheit (Diabetes mellitus, Typ 1) leiden. Das für diese Therapie genutzte menschliche Insulin wird in Escherichia coli biotechnologisch hergestellt. Darüber hinaus sind Produktionssysteme auf der Basis von Säugetierzellen für die biotechnologische Herstellung von therapeutischen Antikörpern im Einsatz.
Bakterielle Produktionssysteme stoßen an Grenzen
Die Nutzung von Bakterien stößt jedoch an Grenzen, denn bestimmte biochemische Reaktionen können diese Lebewesen nicht durchführen – so sind sie nicht in der Lage, an Eiweißmoleküle Zuckerbausteine anzuhängen. Dieser Prozess der Glykosylierung ist eukaryontischen Zellen vorbehalten, die über ein endoplasmatisches Retikulum (ER) und einen Golgi-Apparat verfügen. Da der Zuckercode von Eiweißen für immer mehr therapeutische Ansätze eine wichtige Rolle spielt, ist die Glykosylierung inzwischen auch in der Medikamentenproduktion ein wichtiges Thema, um Eiweiße mit einer ‚menschlichen‘, natürlichen Zuckerstruktur zu erhalten.
Auch Moose eignen sich zur Produktion glykosylierter therapeutischer Eiweiße. Quelle: greenovation Biotech GmbH
Innovative Produktionssysteme auf dem Prüfstand
Auf der Seite der Wissenschaft wird deshalb intensiv daran geforscht, neue oder optimierte Zellsysteme zu entwickeln, mit denen sich die Verzuckerung der therapeutischen Moleküle gezielt initiieren und steuern lässt. Viele Forschungsanstrengungen zielen dabei auf die Optimierung der Glykosylierungsprozesse in Säugetierzellen. Inzwischen gibt es aber auch Ansätze, pflanzliche Systeme wie Moose für die Produktion therapeutischer Eiweiße einzusetzen.
Bei Glykoproteinen werden die Zuckeranteile Schritt für Schritt aufgebaut. Dies geschieht unter Mithilfe einer ganzen Glykosylierungsmaschinerie. Bisher konnten rund 200 Enzyme identifiziert werden, die daran beteiligt sind. Für jedes Eiweiß, das über einen bestimmten Synthesepfad gebildet wird, stehen im Prinzip die gleichen Werkzeuge zur Verfügung. Dennoch kommt es zu Unterschieden in den Glykosylierungsmustern. Diese qualitativen und quantitativen Unterschiede bei der Glykosylierung von Eiweißen werden durch die Spezies und das Gewebe, in dem das Glykoprotein gebildet werden, sowie den physiologischen Zustand (Stoffwechsel, Ernährung) bestimmt. Menschen, denen die genetische Ausstattung zur Umsetzung der Glykosylierung fehlt, leiden unter schweren Organschäden und mentalen Störungen. Ihre Lebenserwartung ist meist nicht sehr hoch. Dies unterstreicht, dass Glykosylierungsprozesse für die Entwicklung des Menschen von enormer Bedeutung sind.
Glykodesigner ändern Zellen nach Maß
Die verschiedenen Einflussfaktoren der Glykosylierung werden nun auch bei der Produktion therapeutischer Eiweiße ausgenutzt. Über die Zellart, deren Entwicklungsstadium und die Zellkulturbedingungen lässt sich die Verzuckerung gezielt verändern und auf genetischer Ebene beeinflussen. Die Zellsysteme, an denen dabei gearbeitet wird, reichen von Säugetierzellen über Pilze bis hin zu Moosen, die jeweils für die biotechnologische Nutzung maßgeschneidert werden müssen (Glykodesign). Welches Expressionssystem schließlich zum Einsatz kommt, ist von der Art des therapeutischen Eiweißes abhängig, das produziert werden soll und immer auch eine Kostenentscheidung. Neue Verfahren – wie beispielsweise die Nutzung von Moosen – bieten Kostenvorteile, haben aber auch den Nachteil zunächst überhaupt ersteinmal industriell etabliert zu sein. Langfristig gehen Experten davon aus, dass mehrere Produktionssysteme parallel existieren werden.
Für biopharmazeutische Produzenten ist Glykodesign ein wichtiges Thema.
Ziel eines solchen Glykodesigns – ob mit tierischen oder pflanzlichen Zellen – ist es zum Beispiel, die Aktivität der Eiweiße zu erhöhen oder deren Halbwertzeit zu verlängern, damit sie vom Körper nicht so schnell abgebaut werden. Auf diese Weise werden sowohl bestehende Medikamente optimiert, als auch neue Arzneien von Anfang an gezielt auf maximale Wirksamkeit bei möglichst niedrigen Dosen ‚getrimmt’.
Ein prominentes Beispiel ist das blutbildende Erythropoetin (EPO), das zur Behandlung von Patienten mit chronischem Nierenversagen oder Blutarmut eingesetzt wird. Mit Hilfe biotechnologischer Verfahren wird humanes EPO seit den 90er Jahren in Bioreaktoren hergestellt. EPO ist ein Glykoprotein mit insgesamt vier Glykosylierungsstellen und so wurde es lange Zeit auch produziert. EPO-Mittel der zweiten Generation verfügen nun jedoch über zwei weitere, zusätzlich angefügte Glykosylierungsstellen, wodurch das Hormon erst viel später durch einen spezifischen Rezeptor in der Leber erkannt und abgebaut wird. Damit müssen Patienten ihr Medikament nur noch einmal pro Woche einnehmen, was eine erhebliche Therapieerleichterung darstellt.
Andere Anstrengungen zielen darauf ab, die Effektivität von sogenannten monoklonalen Antikörpern in der Krebstherapie zu erhöhen. Dafür werden diese therapeutischen Eiweiße gezielt so verändert, dass sie etwa Immunzellen anlocken. Eine solche Steigerung der sogenannten Antikörper abhängigen zellulären Toxitität (ADCC) wird von vielen Glykodesignern verfolgt. Dies bietet Arzneimittelentwicklern sowohl Verbesserungspotenzial für bestehende Krebsmedikamente (mit dem Vorteil eines möglichen neuen Patentschutzes oder Indikationserweiterung) als auch Effizienzsteigerungen bei Neuentwicklungen.
Zucker ebnen Weg für zielgerichtere Medikamente
Verräterische Zuckerstrukturen lassen sich nicht nur für die Diagnose, sondern auch für die Therapie nutzen – indem versucht wird, ihre biologische Funktion zu hemmen und zu stören. Der Eingriff in dieses System erfolgt dabei seltener an den Zuckerbausteinen selbst, als vielmehr bei den entsprechenden Bindungspartnern. Dort werden dann die jeweiligen Rezeptoren so blockiert, dass die Zuckerbausteine kein passendes „Schloss“ mehr finden – und demnach die Reaktion ausbleibt. Solche Blocker können entweder künstlich hergestellte Zuckermoleküle sein oder chemische Moleküle, die die Strukturen der Zucker nachahmen (Glykomimetika). Ein anderer Ansatz besteht darin, die Aktivität von Enzymen, die an der Herstellung der jeweils aktiven Zuckerbausteine beteiligt sind, entscheidend zu beeinflussen.
Die Erforschung von krankheitsrelevanten Zuckerstrukturen und deren therapeutische Nutzung steht jedoch aufgrund der Vielfalt der Zuckerbausteine noch am Anfang. Ein Hauptaugenmerk der Wissenschaft liegt dabei auf den Wechselwirkungen zwischen Glykanen und Lektinen. Lektine (von lat. legere = auflesen, sammeln) sind Rezeptormoleküle, die Zuckerbausteine erkennen und binden können. Sie kommen im Pflanzen- und Tierreich vor und sind für viele medizinische Prozesse relevant. So kann sich das Bakterium Helicobacter pylori mit eigenen Lektinen an Zuckermoleküle heften, die auf den Oberflächen von Magenschleimhautzellen sitzen, und auf diese Weise zur Bildung von Magengeschwüren beitragen. Über Lektine docken auch Bakterien wie Escherichia coli an die Zuckerbausteine von körpereigenen Zellen, was Entzündungen hervorrufen kann. Eine Untergruppe der Lektine, die Galektine, sind wiederum wichtig für das Wachstum und die Ausdifferenzierung von Zellen und können beispielsweise die Zellteilung oder den programmierten Zelltod beeinflussen. Aus diesem Grund wird ihnen eine große Rolle im Zusammenhang mit Krebskrankheiten zugesprochen.
Dieser Film erklärt in englischer Sprache, wie sich die Leukozyten im Innern des Körpers 'fortbewegen'.
Auf der Internetfilmplattform Youtube erklärt ein Film der Universität Harvard in englischer Sprache, wie sich die mit Zuckerantennen ausgestattete weiße Blutkörperchen im Innern des Körpers fotbewegen.Film ansehen
Saure Zuckermoleküle im Fokus
Zu den häufigsten Zuckerbausteinen, an die Lektine binden, gehören Sialinsäuren. Diese Moleküle gehören zu den sauersten im menschlichen Körper und spielen insbesondere für das Immunsystem eine wichtige Rolle: Sie helfen zum Beispiel bei der Ausübung der Schutzfunktion von weißen Blutkörperchen (Leukozyten), die ein Teil des Waffenarsenals des Körpers im Kampf gegen Krankheitserreger und Entzündungen darstellen. Die Zuckerantennen der weißen Blutkörperchen enthalten Sialinsäuren. Daran bindende Lektine, die Selektine, sorgen normalerweise für eine gut funktionierende Abwehr: Sie packen die im Blut zirkulierenden weißen Blutkörperchen an eben diesen Sialinsäuren, locken die Immunzellen aus dem Blutstrom und geleiten sie durch die Wand des Blutgefäßes zum verletzten Gewebe, in das sie dann einwandern können. Am Ort des Geschehens können die weißen Blutkörperchen dann ihre Aufgabe wahrnehmen und Krankheitserreger oder unverträgliche Stoffe unschädlich machen. Inzwischen ist klar, dass eine Störung dieses Prozesses zur Entstehung von Herzinfarkt, Autoimmunkrankheiten sowie Transplantatabstoßungen beiträgt. In diesen Fällen richtet sich der normalerweise nützliche Abwehrmechanismus der Leukozyten gegen den eigenen Körper und erkennt körpereigenes Gewebe fälschlicherweise als fremd.
Die größte Gruppe der Sialinsäure-bindenden Lektine sind die Siglecs. Von dieser Eiweißfamilie sind inzwischen 14 verschiedene Typen bekannt. Sie kommen vor allem auf den Oberflächen von Zellen des Immunsystems vor, beeinflussen die Kommunikation der Immunzellen untereinander und kontrollieren das Ausmaß ihrer jeweiligen Aktivität. So wirken Siglecs bei B-Lymphozyten in der Regel als „Bremse“, damit die Zellen bei ihrer Abwehrarbeit gegenüber körperfremden Eindringlingen nicht zu sehr in Fahrt geraten. Anderseits sind Siglecs auch bei der Ausbildung von Krankheiten beteiligt: Wenn die auf den Immunzellen befindlichen Siglecs mit Sialinsäure in Kontakt kommen, dann werden die Abwehrzellen „quasi blind“. Nun haben Wissenschaftler herausgefunden, dass viele Krebszellen genau diese Taktik benutzen, um sich vor einem Angriff der Immunabwehr zu tarnen. Bei ihnen finden sich überdurchschnittlich viele dieser Sialinsäuren. Damit heften sie sich an die Siglecs der Immunzellen und die Krebszellen bleiben schließlich unentdeckt. Dies wurde unter anderem bei Leukämie im Kindesalter festgestellt, aber auch beim Neuroblastom, einer besonders gefährlichen Krebsart bei Kindern, die im Gehirn auftritt. Als eine Möglichkeit, dieses Tarnsystem der Krebszellen anzugreifen, haben Glykobiologen inzwischen das Enzym GNE (UDP-N-Acetylglucosamin-2-Epimerase/N-Acetylmannosamin-Kinase) entdeckt. Es nimmt bei der Herstellung und Produktion von Sialinsäuren eine Schlüsselstellung ein und konnte von deutschen Wissenschaftlern komplett aufgeklärt sowie funktionell charakterisiert werden. Langfristig können diese Arbeiten die Basis für neue therapeutische Verfahren legen, um die Tarnkappe der Krebszellen gezielt zu zerstören.
Hier ist ein platzendes rotes Blutkörperchen zu sehen, aus dem neue Individuen (Merozoiten) des Malaria-Erregers freigesetzt werden. Quelle: ETH Zürich/Seeberger
Zuckerbasierte Impfstoffe gegen Infektionen
Sialinsäure-Bausteine spielen aber auch bei Infektionskrankheiten eine wichtige Rolle. Über die sauren Zuckerstrukturen bei Glykoproteinen auf der Oberfläche von Zellen werden die Möglichkeiten, von einem Erreger befallen zu werden, erheblich mitbestimmt. Viren oder Bakterien verschaffen sich über die Zuckerstrukturen Eintritt in Zellen, in denen sie sich dann vervielfältigen können.
Bei Malaria-Erkrankungen ist ein Mehrfachzucker, das GPI-Saccharid auf der Oberfläche des Erregers Plasmodium falciparum, maßgeblich am tödlichen Verlauf der Krankheit beteiligt. Im Jahr 2002 wurde das Molekül komplett entschlüsselt und derzeit laufen Arbeiten, um den Stoff künstlich herzustellen und ihn – gebunden an ein Eiweißmolekül – als Impfstoff zu entwickeln. Ein solches Glykoprotein würde vom Körper sehr schnell als fremd erkannt, entsprechend gebildete Antikörper könnten die Patienten im Fall einer Malariainfektion schützen. Beim Milzbranderreger Bacillus anthracis ist ebenfalls bekannt, dass er auf der Oberfläche den Vierfachzucker Anthrose trägt. Bezogen auf dieses Zuckermolekül laufen ebenfalls Arbeiten, Impfstoffe zur präventiven Behandlung von Milzbrand zu entwickeln.
Heutzutage erhältliche Grippeschutzmittel nutzen ebenfalls bestehende Zuckerstrukturen aus. Wie alle anderen Viren auch müssen Grippeviren Zellen infizieren, um sich mit deren Hilfe zu vermehren. Eintritt verschaffen sich die Viren über die Sialinsäure-Bausteine auf der Zelloberfläche – sowohl zum Eindringen als auch zum Verlassen der Zelle. Die Viren verfügen über spezielle Glykoproteine – die Neuraminidasen – die über enzymatische Aktivitäten die Sialinsäure auflösen können. Grippemittel hemmen nun gezielt die Enzymaktivität der Neuraminidasen und verhindern auf diese Weise eine Ausbreitung des Virus.
Biomaterialien und Lebensmittel im Visier der Zuckerforscher
Die Zuckerforschung beschränkt sich nicht nur auf den medizinischen Bereich. Bioaktive Zuckerverbindungen spielen auch bei der Entwicklung von Lebensmitteln eine immer wichtigere Rolle – nicht nur, um ihnen Süße zu verleihen. Vielmehr verstehen Forscher immer besser, welchen Einfluss etwa bestimmte Zuckerverbindungen in Lebensmitteln bei der Anheftung und Abwehr von Krankheitserregern im menschlichen Verdauungstrakt haben. Dieses Wissen kann nun zielgerichtet für die Herstellung neuer Produkte eingesetzt werden, um Lebensmittel mit Zusatzstoffen anzureichern, die prophylaktisch wirken oder als Therapeutikum eingesetzt werden können. Die Forschungsarbeiten zu solchen, auch Functional Food genannten Lebensmitteln hat in den vergangenen Jahren einen enormen Aufschwung genommen, und die Glykobiologen können hier zu neuen Entwicklungen beitragen.
Verträgliche Implantate
Letztlich kommen Zuckermoleküle aber auch bei der Entwicklung innovativer Biomaterialien zum Einsatz. Als Biomaterialien gelten dabei nicht nur Implantate und Prothesen, sondern auch alle weiteren Werkstoffkomponenten, die mit biologischen Systemen interagieren und dort eine Funktion übernehmen. Für viele Behandlungen ist der Einsatz solcher Materialien unabdingbar, allerdings dürfen sie dafür keine Abwehrreaktionen des Körpers hervorrufen.
Weil die Verträglichkeit stark von der chemischen Zusammensetzung des Materials und seiner Oberflächenstruktur abhängt, sind hier zunehmend Glykobiologen und ihr Wissen um die Bedeutung von Zuckerstrukturen auf Zelloberflächen gefragt. Ein Ziel der Forscher besteht beispielsweise darin, natürliche Oberflächen nachzuahmen und mit bioaktiven Elementen auszustatten.
Biomaterialien: Impulse für Innovationen
In dem Maße, wie die biomedizinische Forschung voranschreitet und neue Methoden zur Behandlung von Krankheiten entdeckt, spielt der Einsatz von Biomaterialien eine immer größere Rolle. Dabei versteht man unter Biomaterialien nicht nur Implantate und Prothesen, sondern auch alle weiteren Werkstoffkomponenten, die mit biologischen Systemen interagieren und dort eine Funktion übernehmen. Dazu zählen beispielsweise Materialien, die zur Züchtung von körpereigenen oder künstlichen Ersatzgeweben genutzt werden, oder polymere Partikel, die pharmakologische Wirkstoffe im Körper freisetzen können.
Damit solche Materialen aber auch tatsächlich beim Menschen eingesetzt werden können, dürfen keine Unverträglichkeiten wie Entzündungen oder Abstoßungsreaktionen auftreten. Die Erkenntnisse der Glykobiologen wurden hierbei lange vernachlässigt, doch inzwischen gibt es etliche Wissenschaftler in der Materialforschung, die auf Erfahrungen mit Zuckerstrukturen zurückgreifen und diese gezielt bei der Oberflächengestaltung einsetzen – schließlich hängt die Biokompatibilität von Materialien stark von ihrer chemischen Zusammensetzung und Oberflächenstruktur ab.
Reduktion der komplexen Dynamik von lebenden Zellen durch Modellsysteme
Viele lebende Zellen statten sich mit einer gelartigen Hülle aus, die eine beeindruckende Dicke von mehreren Mikrometern erreichen kann, starke Anlagerungen von Wassermolekülen zeigt (Hydratisierung) und an der Zellmembran befestigt ist. Diese sogenannten perizellulären Hüllen sind faszinierende selbstorganisierende Systeme. Sie spielen eine Rolle in vielerlei grundlegenden Prozessen der Zelle, wie ihrer Teilung, Migration, Haftung, in der Signalgebung oder im Stofftransport. Eine entscheidende Komponente der Hüllen ist Hyaluronan, ein langkettiger Zucker von bis zu mehren Mikrometern Länge.
| Mehr Informationen zum Thema auf biotechnologie.de |
| Einblick in die Zuckerhülle lebender Zellen |
Die in vivo-Untersuchung perizellulärer Hüllen stellt auch heute noch eine Herausforderung dar. Für eine genaue Analyse der physikalischen Gesetzmäßigkeiten, die der Struktur und Funktion dieser Hüllen zugrundeliegen, ist es wünschenswert, von lebenden Zellen mit ihrer komplexen Dynamik zu kontrollierten Modellsystemen mit regelbarer Komplexität wechseln zu können. Wissenschaftler versuchen deshalb, auf Hyaluronan basierende Modellsysteme auf festen Oberflächen zu erstellen, um die Zellhüllen für biophysikalische ntersuchungstechniken zugänglich zu machen.
Das Bild zeigt den schematischen Aufbau einer Zelloberfläche als Querschnitt durch eine Zellmembran: In ihr sind die Glykoproteine und Glykolipide verankert und können mit der Umwelt interagieren. Biomaterialforscher wollen diesen Aufbau nachbauen.
Natürliche Oberflächen nachahmen
Ein weiterer Ansatz in der Biomaterialforschung besteht darin, mit Biohybridsystemen die natürlichen, mit Zuckern versehenen Oberflächen nachzuahmen. Auf diese Weise können Fremdmaterialien vor dem menschlichen Abwehrsystem wirksam getarnt werden. Darüber hinaus können Erkenntnisse aus der Zuckerforschung dazu beitragen, Materialien mit biologischen Funktionen auszustatten, durch die zelluläre Antworten wie Adhäsion, Wachstum und Differenzierung zellspezifisch und ortsgerichtet durch das eingesetzte Biohybridsystem eingeleitet wird. Hierbei werden zum Beispiel Verfahren verfolgt, die sowohl chemische als auch biologische Komponenten miteinander verknüpfen.
Einen solchen Weg beschreitet Lothar Elling von der Rheinisch-Westfälischen Technischen Hochschule (RWTH) Aachen als leitender Professor in der Biomaterialforschung. Im Rahmen mehrerer Forschungsprojekte, die durch die Europäische Union sowie die Deutsche Forschungsgemeinschaft (DFG) finanziell unterstützt werden, soll die Herstellung von neuartigen biohybriden Grenzflächen vorangetrieben werden, bei denen auf der Oberfläche von Materialien eine sogenannte extrazelluläre Matrix (ECM) nachgebildet wird. Den Wissenschaftlern ist es dabei bereits gelungen, einen Baukasten aus Enzymen und bestimmten Lektinen, den Galektinen, zu erstellen. Dieser ermöglicht es, die Glykane der Zelloberfläche zu synthetisieren und Galektine auf ihre Bindungseigenschaft hin zu charakterisieren. Um die Oberfläche einer Zelle nachzuahmen, werden die Glykane dabei über geeignete chemische Gruppen auf den mit einem Hydrogel beschichteten Biomaterialien immobilisiert. Die auf dieser Zuckeroberfläche bindenden Galektine vermitteln die weitere Anbindung von Glykoproteinen der ECM – eine solche „layer-by-layer“ Technologie ermöglicht also zumindest den teilweisen Nachbau der ECM auf diesen Oberflächen.
Erste Zellexperimente mit Fibroblasten konnten zudem zeigen, dass die süßen Oberflächen angenommen werden. Zukünftige Arbeiten sollen dieses neue Prinzip der Biofunktionalisierung von Biomaterialoberflächen mit weiteren Zellexperimenten (verschiedene Zelltypen), mit der Einbindung weiterer humaner Galektine und mit der Synthese von verzweigten Kohlenhydratstrukturen weiter untermauern.
Großes Zuckermolekül dient als Vorbild für Gerüstmaterial
Ein anderer Ansatz in der Biomaterialforschung besteht darin, Zuckerstrukturen als Gerüstsubstanz bei der Züchtung von künstlichen Ersatzgeweben und Transplantaten zu nutzen. Solche Gerüste, die auch scaffolds genannt werden, bilden das Gewebe oder Organ nach, dienen als Träger für Zellen und sind eine mechanische Stütze für die Zusammenführung verschiedener Gewebe. Solche Organgerüste dürfen allerdings keinen permanenten Charakter haben, da sie die Funktion des Transplantats behindern würden. Im Idealfall werden deshalb Gerüste benutzt, die sich in einem geregelten Prozess parallel zur Bildung des künstlichen Organes zurück- bzw. abbauen – ohne dabei toxische Eigenschaften zu entwickeln.
Inzwischen haben Wissenschaftler ein im menschlichen Körper gebildetes großes Zuckermolekül, die Polysialinsäure, als mögliches Scaffold-Material identifiziert: Sie ist unter physiologischen Bedingungen sehr stabil und der Abbau kann über hoch spezifische Enzyme eingeleitet werden. Darüber hinaus ist es denkbar, die zahlreichen funktionellen Gruppen des Zuckers zu nutzen, um seine Eigenschaften gezielt auf organisch- und anorganisch-chemischem Wege zu verändern beziehungsweise für den jeweiligen Einsatz zu optimieren.
Lebensmittel: Bioaktive Helfer gegen Krankheitserreger
Weshalb wird die Kruste des Brotes beim Backen braun? Warum riecht es so gut, wenn der Bäcker den Ofen mit frischen Brötchen öffnet? Und wodurch kommen die Bratendüfte zustande, wenn ein Steak in der Pfanne gebraten wird? Beim Braten, Backen und Rösten kommt eine biochemische Reaktion zustande, die heute unter dem Namen ihres Entdeckers – des französischen Biochemikers Louis Maillard – benannt ist: die Maillard-Reaktion.
Darunter werden Bräunungsprozesse bei sehr hohen Temperaturen ab etwa 140 Grad Celsius verstanden, die ohne die katalytische Wirkung von Enzymen zustandekommen. Stattdessen spielen im Fleisch oder im Brot enthaltene Zucker- und Eiweißmoleküle eine wichtige Rolle. Hierbei werden Aminosäuren und reduzierende Zucker unter der großen Hitzeeinwirkung zu neuen Verbindungen umgewandelt. Die ersten analytisch fassbaren Zwischenprodukte der Maillard-Reaktion sind die Fructose-Aminosäuren, die sogenannten Amadori-Verbindungen, die wiederum zu den unterschiedlichsten Folgeprodukten weiterreagieren. Mehrere dieser Fructose-Aminosäuren wurden Anfang der 90er Jahre erstmals in rohen Kakaobohnen nachgewiesen.
Ohne Zucker kein Aroma
Die Anzahl aller Maillard-Reaktionsprodukte ist sehr hoch, viele von ihnen sind auch noch unbekannt. Zu den bedeutendsten zählen bestimmte Pigmente, die Melanoide. Sie tragen nicht nur zur bekannten braunen Färbung von eiweißreichem Geröstetem, Gebratenem und Gebackenem bei, sondern verursachen auch das geschmacksintensive Aroma. Die Melanoide sind deshalb nicht nur beim Kochen, sondern auch in der Lebensmittelindustrie von Bedeutung. So lässt sich mit dem gezielten Einsatz von Amadori-Verbindungen die Aroma-Ausbeute steigern. Allerdings können durch die Maillard-Reaktion auch unerwünschte Geschmacksveränderungen auftreten, etwa bei der Sterilisierung von Fleisch und Milchprodukten oder die bei großer Hitze stattfindende Bildung des Karzinogens Acrylamid aus der Aminosäure Asparagin in Kartoffelprodukten wie Pommes frites. Die Forschung über den Einfluss der Maillard-Reaktion im menschlichen Körper steht allerdings noch am Anfang.
So wird ihr unter anderem eine Rolle bei Alterungsvorgängen und der Zuckerkrankheit Diabetes mellitus zugewiesen, da während der Maillard-Reaktion ablaufende oxidative Prozesse zu einer Schädigung von Gewebeeiweißen führen können. Anderseits konnten Wissenschaftler bereits Maillard-Produkte entwickeln, die gezielt die Aktivität von Lektinen blockieren und auf diese Weise einer Entstehung von Krebsmetastasen entgegengewirkt haben. Zudem konnte bei einigen Melanoiden eine antibakterielle Wirkung nachgewiesen werden.
Gesundheitsfördernder Einfluss durch wertvolle Zucker
Ein großer Teil der Glykobiologen in der Lebensmittelforschung beschäftigt sich mit dem gesundheitsfördernden Einfluss von in Lebensmitteln vorkommenden Zuckerverbindungen – beispielsweise bei der Anheftung und Abwehr von Krankheitserregern im menschlichen Verdauungstrakt sowie der Stärkung des Immunsystems. Solche wertvollen Zucker sind in großen Mengen in der Muttermilch, aber nur in sehr geringen Konzentrationen in der Kuhmilch enthalten. So konnten bereits mehr als 100 verschiedene Mehrfachzucker (Oligosaccharide) in menschlicher Muttermilch nachgewiesen werden, die einen günstigen Einfluss auf die Besiedlung der Darmflora haben und verhindern, dass sich bestimmte Bakterien oder Viren an den Gefäßzellen anhaften können. Dies geschieht meist auf indirekte Art und Weise – indem die Zuckerbausteine den ‚positiven’ Darmbakterien wie Milchsäurebakterien als Nahrung dienen und ihnen helfen, sich auszubreiten.
Eine Reihe von Forschungsarbeiten beschäftigt sich damit, künstlich hergestellte Lebensmittel mit solchen gesundheitsfördernden, bioaktiven Zuckerverbindungen anzureichern. Viele solcher als Functional Food bezeichneten Lebensmittelprodukte befinden sich derzeit in der Entwicklung bzw. sind teilweise schon auf dem Markt. Auf der anderen Seite wird an Analyseverfahren gearbeitet, die wertvollen Mehrfachzucker und Glykoproteine in unterschiedlichen Milchfraktionen auch in geringen Konzentrationen aufzuspüren und zu charakterisieren, um daraus neuartige Lebensmittel zu entwickeln. Andere Ansätze beschäftigen sich damit, den in der industriellen Produktion von Käse massenhaft anfallenden Milchzucker mithilfe gezielt eingeleiteter enzymatischer Verfahren in einen gesundheitsfördernden Lebensmittelzusatz zu verwandeln.
Wirtschaftliche Bedeutung der Glykobiologie
Da Biopharmazeutika in der Mehrheit therapeutische Proteine sind, bei denen Zuckerstrukturen einen Einfluss auf die Stabilität, Aktivität, Halbwertszeit und Immunogenität haben, spielen glykobiologische Ansätze bei der biotechnologischen Herstellung von Medikamente eine zunehmende Rolle. Glykosylierung ist deshalb für jeden Hersteller biopharmazeutischer Arzneien ein wichtiges Thema und damit wirtschaftlich gesehen kein Nischenfaktor. So tragen Biotechnologie-Medikamente einen immer größeren Anteil am Umsatz mit Arzneimitteln in Deutschland bei. Im Jahr 2006 der gesamte Umsatz der deutschen Pharmaindustrie laut VFA 25,4 Milliarden Euro, 12 Prozent (3,1 Milliarden Euro) gehen dabei auf das Konto der Biotechnologie. Einen großen Anteil an biopharmazeutischen Medikamenten stellen Therapien gegen Krebs dar. Sie machen mit über 373 Millionen Euro fast 12% des Umsatzes aller Biopharmazeutika in Deutschland aus.
Viele Krebsmedikamente zählen in wirtschaftlicher Hinsicht zur Gruppe der Blockbuster – sind also Medikamente, die mehr als eine Milliarde Umsatz pro Jahr erwirtschaften. Experten gehen davon aus, dass sich diese Zahlen in den kommenden Jahren noch erhöhen werden. Ein Drittel aller neu zugelassenen Medikamente pro Jahr sind biotechnologischer Herkunft und mehr als 300 Medikamenten-Kandidaten befinden sich nach Angaben des VFA aktuell in der klinischen Entwicklung. Die meisten Anstrengungen beziehen sich dabei auf die Umsetzung neuer Behandlungsansätze für verschiedene Krebserkrankungen. Und auch hier dürften glykobiologische Verbesserungen künftig für viele Arzneientwickler interessant sein - auch mit Hinblick auf einen neuen Patentschutz für Biotech-Medikamente der ersten Generation.
Wirtschaftliche Dynamik zeigt aber auch der Bereich Functional Food. Insbesondere große Unternehmen wie Nestlé und Danone liefern sich derzeit große Übernahmeschlachten. Der Kampf dreht sich vor allem um Babynahrungshersteller - hier erhoffen sich die Nahrungsmittelhersteller einen großen Markt für Produkte mit gesundheitsfördernden Eigenschaften.
Glyko-Engineering bei Biopharmazeutika auf dem Vormarsch
Schon heute gibt es eine Reihe von Biotechnologie-Präparaten mit maßgeschneidertem Zuckermuster: Ob Antikörper, Wachstumsfaktoren oder Hormone – eine Vielzahl heutiger auf dem Markt befindlicher Biopharmazeutika ist glykosyliert. Dabei handelt es sich nicht um Produkte mit geringem Umsatz:
| Medikament | Firma | Weltweiter Umsatz 2006 |
| Aranesp | Amgen | 4,1 Mrd. Dollar |
| MabThera | Biogen Idec, Genentech, Roche | 3,9 Mrd. Dollar |
| Herceptin | Genentech, Roche | 3,1 Mrd. Dollar |
| Avastin | Genentech, Roche | 2,4 Mrd. Dollar |
| Erbitux | Imclone, BMS, Roche | 1,1 Mrd. Dollar |
Quelle: Nature Biotechnology (04/2007); Amgen Geschäftsbericht 2006
Allein mit dem blutbildenden Glykoprotein Erythropoetin (EPO), das zur Behandlung von Patienten mit chronischem Nierenversagen oder Blutarmut eingesetzt wird, werden jedes Jahr Umsätze in Milliardenhöhe erwirtschaftet. So erzielte das amerikanische Biotechnologie-Unternehmen Amgen im Jahr 2006 mit seinen zwei EPO-Mitteln Epogen und Aranesp die Hälfte seines gesamten Jahresumsatzes. Gut vier Milliarden Dollar gingen dabei auf das Konto des glykosylierten Produkts Aranesp. Diese EPO-Variante ist ein Mittel der sogenannten zweiten Generation, das über zwei zusätzlich angefügte Glykosylierungsstellen verfügt. Diese tragen dazu bei, dass das Hormon erst viel später durch einen spezifischen Rezeptor in der Leber erkannt und abgebaut wird. Damit müssen Patienten ihr Medikament nur noch einmal pro Woche einnehmen.
Aber nicht nur EPO, auch eine Reihe von umsatzstarken monoklonalen Antikörpern (mAbs) gegen Krebs (vgl. Tabelle) sind glykosyliert – hier tragen die Zuckerstrukturen stark zur Funktionalität der Therapeutika bei. Kohlenhydrat-Anteile sind in allen Antikörpern vorhanden, aber durch gezieltes Glykoengineering kann beispielsweise spezifisch die Antikörper-abhängige zelluläre Toxizität (ADCC) gestärkt werden. Dieser Immuneffektormechanismus ist für die Killeraktivität von Antikörpern gegenüber den Zielzellen ausschlaggebend, und ein gezielter Eingriff kann zu einer verbesserten Wirksamkeit des therapeutischen Antikörpers führen.
2005: Pharma setzt auf Glyko-Firmen
Dass die Pharmaindustrie an solchen Antikörper-Technologien stark interessiert ist, haben gezielte Übernahmen von Unternehmen auf diesem Gebiet gezeigt. So hat sich der Schweizer Pharmakonzern Roche im Jahr 2005 die Übernahme von Glycart Biotechnology 143 Millionen Euro kosten lassen. Das aus der Eidgenössischen Technischen Hochschule (ETH) in Zürich ausgegründete Unternehmen hat eine Technologie entwickelt, mit der sich die Zuckerstrukturen von therapeutischen Antikörpern gezielt verändern lassen. Im gleichen Jahr sicherte sich der amerikanische Konzern Merck & Co. eine 295 Millionen Euro schwere strategische Allianz mit der US-Firma GlycoFi, die eine Plattform zum Glycoengineering von Hefezellen entwickelt hat.
Auf der anderen Seite gibt es Strategien, solche Antikörper zu identifizieren, die gezielt spezielle Glykosylierungsmuster von therapeutisch relevanten Zieleiweißen erkennen können. Dieser Ansatz wird beispielsweise in der Krebstherapie von der in Würzburg ansässigen Biotechnologie-Firma Oncomab verfolgt, die im Juli 2007 als Patrys Ltd. in Australien an die Börse ging.
Mit Moosen Medikamente im Photobioreaktor herstellen: Das Heilbronner Unternehmen greenovation Biotech GmbH setzt darauf.
Gute Nachrichten für Glykobiologie in der deutschen Biotechnologie-Branche
In vielen deutschen Biotechnologie-Unternehmen spielen glykobiologische Ansätze eine zunehmend wichtigere Rolle, schließlich beschäftigt sich die Mehrheit der insgesamt 500 Biotech-Firmen in Deutschland mit der Entwicklung von neuartigen Therapien und Diagnostika. Gut ein Dutzend deutscher Biotechnologie-Firmen hat seinen Fokus auf die Glykobiologie gelegt bzw. übernimmt Dienstleistungen in der Glykoanalytik. Damit zählt Deutschland neben Frankreich und Großbritannien zu jenen europäischen Ländern, in denen die Glykobiologie auch in wirtschaftlicher Hinsicht am intensivsten verfolgt wird. Dies erfolgt jedoch noch in vergleichsweise geringem Umfang, was Mitarbeiter- und Umsatzzahlen angeht. Wie bei den meisten deutschen Biotechnologie-Unternehmen gehören auch diese Firmen zum Mittelstand und beschäftigen lediglich zwischen 8 und knapp 80 Mitarbeitern. Im Vergleich zu 2005 zeigte sich 2006 jedoch eine leichter Aufwärtstrend bei der Anzahl der Beschäftigten.
40 Millionen Euro für Glycotope in Berlin
Auftrieb geben zudem zwei jüngste Nachrichten: Das Berliner Unternehmen Glycotope konnte Ende Oktober eine Finanzierungsrunde von 40 Milllionen Euro abschließen. Das Geld stammt von der Jossa Arznei GmbH München, die den ehemaligen Hexal-Gründern Thomas und Andreas Strüngmann gehört. Mit dem Geld sollen sowohl eigene klinische Entwicklungen als auch Auftragsprodukte entscheidend vorangetrieben werden. Glycotope hat gemeinsam mit Berliner Wissenschaftlern des Max-Delbrück-Centrums eine Glykosylierungstechnologie entwickelt, die es erlaubt, Säugetierzellen gezielt so zu verändern, dass maßgeschneiderte Medikamente produziert werden können. Bislang konzentrierte sich die Firma hauptsächlich auf Dienstleistungen. Mit dem frischen Geld kann das Unternehmen seine eigenen Arzneimittelkandidaten weiterentwickeln (Antikörper gegen Krebs) und in die klinische Prüfung bringen.
Greenovation koopiert mit Satorius Stedim Biotech
Gute Nachrichten hatte im Oktober auch die greenovation Biotech GmbH zu vermelden, die ein Produktionsverfahren für glykosylierter Biopharmazeutika auf der Basis von Moosen etablieren will: Mit Sartorius Stedium Biotech aus Göttingen beteiligt sich ein industriell angesehender Anbieter von Prozess- und Labortechnologien in der biopharmazeutischen Produktion am Aufbau des ersten Photobioreaktors im Industriemaßstab in Heilbronn. Die Anlage soll 2010 betriebsbereit sein. Sie wird finanziert durch die im Jahr 2006 abgeschlossene Finanzierungsrunde in Höhe von 5,4 Millionen Euro, an der sich der Zukunftsfonds Heilbronn mit 3,5 Millionen Euro maßgeblich beteiligt hat.
Nach Angaben der Firma bestehen schon jetzt ein gutes Dutzend Kooperationen - sowohl mit Biotechnologie-Unternehmen als auch mit Pharmakonzernen. Ziel ist, sich schon früh im Entwicklungsstadium einer Arznei als Produktionssystem zu etablieren. Bis zu einer klinischen Phase II will greenovation dabei die Produktion selbst übernehmen, die dritte klinische Prüfungsphase ist dann in Kooperation mit anderen Produktionspartnern geplant.
Dynamischer Konkurrenzkampf bei Functional Food
Neben den medizinischen Anwendungen beeinflussen glykobiologische Ansätze auch verstärkt die Lebensmittelbranche. In den vergangenen Jahren hat sich diese Branche immer mehr darauf konzentriert, Nahrungsprodukte gezielt mit zusätzlichen gesundheitsfördernden Eigenschaften auszustatten. Der Markt für solche als Functional Food bezeichneten Lebensmittel beginnt sich gerade erst zu etablieren. Da es an stichhaltigen Definitionen fehlt, welche Produkte dazu zählen und welche nicht, ist die exakte Größe dieses Marktes nur schwer in Zahlen zu fassen. Theoretisch könnte er mehrere Milliarden Euro umfassen, für Deutschland gehen Experten der Ernährungsforschung von einem Potenzial in Höhe von 2,5 Milliarden Euro aus. Bis 2011 wird eine Verdopplung erwartet. Allein mit probiotischen Joghurts, Trinkjoghurts oder Cholesterin senkenden Produkten wird derzeit ein Umsatz von 400 Millionen Euro in Deutschland erwirtschaftet (Consumer Scan Haushaltspanel).
Die Weiterentwicklung von neuartigen Lebensmitteln besitzt bei großen Konzernen wie Nestlé einen hohen Stellenwert. Jährlich stecken die Schweizer rund eine Milliarde Euro in die Forschung und Entwicklung. Ein Ziel besteht darin, für verschiedene Zielgruppen Lebensmittel mit spezifischem Zusatznutzen zu entwickeln. Bereits heute erwirtschaftet Nestlé nach Aussage von Vorstandsmitglied Werner Bauer sieben Milliarden Euro pro Jahr mit Functional Food. Glykobiologische Ansätze sind vor allem bei der Herstellung von Babynahrung interessant. Schließlich konnten wissenschaftliche Arbeiten bereits nachweisen, dass bioaktive Zuckermoleküle in der Muttermilch gesundheitsfördernd für Kinder sind. Hersteller von Babynahrungsmitteln unternehmen daher große Anstrengungen, damit die Produkte dem natürlichen Vorbild möglichst nahe kommen. Experten erwarten hier zweistellige Wachstumsraten.
Große Konzerne im Übernahmefieber
Vor diesem Hintergrund sind auch aktuelle Übernahmeaktivitäten großer Lebensmittelkonzerne zu sehen: So hat Nestlé erst im April 2007 die auf Babynahrung spezialisierte Novartis-Tochter Gerber für 5,5 Milliarden Euro übernommen. Auch beim niederländischen Nahrungsmittelhersteller Royal Numico, zu dem seit 1995 das deutsche Unternehmen Milupa gehört, nimmt Babynahrung einen großen Anteil an der Geschäftstätigkeit ein. In Deutschland ist Milupa an mehreren Forschungsprojekten beteiligt, um die gesundheitsfördernden Eigenschaften von Babymilchprodukten zu steigern. Allein Numico hat im Jahr 2006 laut Geschäftsbericht mit Babynahrung 1,9 Milliarden Euro erwirtschaftet. Dass dies ein wirtschaftlich lukratives und aktuell sehr dynamisches Feld ist, zeigt nun die von der EU-Kommission genehmigte Fusion zwischen dem französischen Lebensmittelhersteller Danone mit dem Rivalen Numico. Die Brüsseler Behörde verknüpfte die Genehmigung Ende Oktober jedoch mit der Auflage, bestimmte Geschäftsbereiche zu verkaufen. So muss der fusionierte Konzern das Numico-Geschäft mit Baby-Getränken in Frankreich abgeben. In Belgien und den Niederlanden müssen bestimmte Bereiche des Baby-Nahrungsmittelgeschäfta von Danone verkauft werden. Für die Fusion legt Danone 12,3 Milliarden Euro auf den Tisch und verschärft damit den Konkurrenzkampf mit Nestlé.
Neue EU-Health-Claim-Ordnung in Kraft getreten
Pharmaindustrie und Lebensmittelbranche verdeutlichen eindrucksvoll, dass sich glykobiologische Ansätze in profitablen Märkten bewegen und zur Wertschöpfung in Deutschland beitragen können. Für die Arzneimittelindustrie ist dabei schon heute absehbar, dass die Biotechnologie künftig noch mehr an Bedeutung gewinnen wird. Damit sind auch Fortschritte in der Glykobiotechnologie zu erwarten, die sich langfristig in neuen Produkten und Dienstleistungen widerspiegeln werden. Ähnliche Entwicklungen werden für Functional Food im Lebensmittelsektor prognostiziert.
Allerdings nehmen gerade in diesem Feld auch die gesetzlichen Bestimmungen zu: So ist Anfang Juli die neue Health-Claims-Verordnung EG Nr. 1924/2006 des Europäischen Parlaments in allen EU-Mitgliedsstaaten in Kraft getreten. Nährwert- und gesundheitsbezogene Angaben der Werbung und Kennzeichnung von Lebensmitteln, einschließlich Nahrungsergänzungsmitteln, unterliegen von nun an detaillierten Anforderungen. Angaben über die Verringerung eines Krankheitsrisikos unterliegen Sondervorschriften und müssen ein Zulassungsverfahren durchlaufen. Der überwiegende Teil der erlaubten Health Claims muss allerdings noch von der Europäischen Behörde für Lebensmittelsicherheit (EFSA) festgelegt werden. Dies soll bis spätestens 2010 geschehen. Bis dahin gelten Übergangsregeln.
Öffentliche Förderung: BMBF unterstützt Glykobiotechnologie
Innovative Forschung auf dem Gebiet der Glykobiologie wird von der Bundesregierung seit Jahren im Rahmen der gezielten Förderung der Biotechnologie vorangetrieben. Die 2006 beschlossene Hightech-Strategie der Bundesregierung, die auf einen beschleunigten Transfer von Forschungsergebnissen in die Praxis zielt, räumt der Biotechnologie und den Lebenswissenschaften auch für die Zukunft viel Platz ein. Für die Projektförderung in den Lebenswissenschaften stellt das BMBF jedes Jahr rund 300 Millionen Euro zur Verfügung – Tendenz steigend. Damit werden sowohl akademische Projekte unterstützt als auch gemeinschaftliche Forschungs- und Entwicklungsvorhaben mit der privaten Wirtschaft. Einige Fördermaßnahmen des BMBF sind explizit auf die Glykobiotechnologie ausgerichtet (z.B. der Arbeitsgruppenwettbewerb Glykobiotechnologie), andere wie KMU-innovativ oder GO-Bio sind themenübergreifend angelegt und stehen dadurch auch Projekten aus der Glykobiotechnologie offen.
KMU-Förderung: Risikoreiche Projekte vorantreiben
Die Fördermaßnahme BioChancePlus richtet sich an kleine und mittlere Biotechnologie-Unternehmen. In vier Auswahlrunden (2004-2007) wurden Forschungs- und Entwicklungsvorhaben einzelner Firmen sowie deren Kooperation untereinander oder mit größeren Konzernen unterstützt. Diese Förderung hat mit dazu beigetragen, dass sich in Deutschland eine Szene an glykobiologisch orientientierten Biotechnologie-Unternehmen etabliert hat. Ab Herbst 2007 wird die erfolgreiche Förderung von BioChancePlus unter dem neuen Dach von KMU-innovativ weitergeführt. Mit KMU-innovativ soll die Förderung kleiner und mittlerer Unternehmen in verschiedenen Technologiefeldern durch das BMBF weiter vereinheitlicht, vereinfacht und beschleunigt werden. Ein eigens für KMUs eingerichteter Lotsendienst dient dabei als erste Anlaufstelle und Einstieg, um sich hinsichtlich einer BMBF-Forschungsförderung beraten zu lassen. Dies soll auch unerfahrenen Unternehmen die Möglichkeit geben, Förderung für ein anspruchsvolles, innovatives Forschungsprojekt durch das BMBF zu erhalten.
GO-Bio: Ausgründungen auf den Weg helfen
Ziel der Fördermaßnahme GO-Bio ist es, gründungsbereiten Wissenschaftlerteams aus den Lebenswissenschaften frühzeitig Impulse für technologisch anspruchsvolle und damit risikoreiche Projekte zu geben, die wirtschaftlich anschlussfähig sind und möglicherweise zu einer Unternehmensgründung führen können. Gezielt werden die Schritte aus dem wissenschaftlichen Umfeld in den unternehmerischen Kontext gefördert, u.a. auf Basis eines Geschäftsplans, einer wirtschaftlich erfolgversprechenden Schutzrechtsposition oder auch einer nach den Maßstäben potenzieller industrieller Kooperationspartner ausreichenden Entwicklungsdokumentation und Qualitätssicherung.
Unternehmen Region: Regionale Netzwerke stärken
In den vergangenen Jahren hat das BMBF zudem mit dem regional orientierten Förderprogramm Unternehmen Region zum Aufbau von Kooperationen zwischen akademischen Forschungseinrichtungen und Unternehmen in der Glykobiologie beigetragen. Dieses auf Ostdeutschland fokussierte Förderprogramm unterstützt beispielsweise Forschungsgruppen und Unternehmen der Glykobiotechnologie im Raum Berlin/Brandenburg im Rahmen der Initiative InnoProfile.
Die gezielte Unterstützung glykobiotechnologischer Vorhaben wurde zwischen 1994 und 2002 durch einen auf dieses Forschungsfeld konzentrierten Förderschwerpunkt beim BMBF realisiert. Dadurch konnten insgesamt 13 interdisziplinäre Verbünde mit 51 Partnern aus Forschung und Industrie finanziell begleitet werden. Die Projektpartner verfolgten dabei glykobiotechnologische Ansätze sowohl in der Pharma- und Nahrungsmittelindustrie als auch für analytische und apparative Anwendungen. Das BMBF hat dafür insgesamt 15 Millionen Euro bereitgestellt und mobilisierte auf diese Weise einen ebenso hohen Betrag aus der Wirtschaft.
Neu: Arbeitsgruppenwettbewerb Glykobiotechnologie
Mit dem im Jahr 2006 initiierten Arbeitsgruppenwettbewerb Glykobiotechnologie will das BMBF dieses hochinnovative Forschungsfeld an deutschen Hochschulen sowie Forschungseinrichtungen in den kommenden Jahren nachhaltig etablieren. Die geförderten Gruppen verfolgen anwendungsorientierte Forschungsansätze und sollen wissenschaftlich attraktive Kristallisationspunkte bilden. Auf diese Weise soll die glykobiotechnologische Forschung in Deutschland insbesondere als Voraussetzung für Innovationen in der Pharma- und Biotech-Industrie weiterentwickelt und gestärkt werden, um die internationale Wettbewerbsfähigkeit Deutschlands auf dem Gebiet der Glykobiotechnologie weiter auszubauen.














