Regenerative Medizin: Heilen mit Zellen
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
- Die Regenerative Medizin setzt auf den heilenden Einfluss von lebenden Zellen, um so Verletzungen oder Erkrankungen zu behandeln. Oft werden die Zellen noch mit Biomaterialien - hier Hightechfäden -kombiniert. Quelle: Jürgen Groll/Universität Würzburg
Die Regenerative Medizin nutzt die Selbstheilungskräfte des Körpers, um Erkrankungen und Verletzungen zu therapieren. Dabei setzen Mediziner und Naturwissenschaftler auf den Einfluss lebender Zellen. Neue und individuelle Therapien könnten Patienten, so die Hoffnung, eine deutlich höhere Lebensqualität ermöglichen. Mit einem Dossier und einer Broschüre beleuchtet biotechnologie.de, wie das Forschungsgebiet in Deutschland aufgestellt ist, für welche Erkrankungen es bereits vielversprechende Fortschritte gibt und wieso der Weg für zellbasierte Therapien in den klinischen Alltag so schwierig ist. Als Spitzenzentren für die Regenerative Medizin sind in Deutschland sogenannte Translationszentren in Leipzig, Berlin, Dresden, Hannover und Rostock aufgebaut worden. Auch für die Pharma- und die Kosmetikindustrie werden Verfahren der Regenerativen Medizin immer bedeutender.
Was ist Regenerative Medizin ?
Die Fähigkeit zur Regeneration ist lebensnotwendig. Unter Regeneration wird in der Biologie die Fähigkeit eines Organismus verstanden, verloren gegangene Körperteile und Körperfunktionen von Grund auf zu ersetzen – um so möglichst den gesunden Originalzustand wiederherzustellen. Diese Regenerationsfähigkeit besitzen prinzipiell alle Lebewesen – aber nur bis zu einem bestimmten Grad. Die treibende Kraft dieser Selbstheilungsfähigkeit geht von den Zellen aus, die die betroffenen Gewebe und Organe aufbauen. Bei Menschen ist die Regenerationsfähigkeit gerade bei den Organen ausgeprägt, die in hohem Maße beansprucht werden: Knochenmark, Leber, die obere Hautschicht oder etwa die Darmschleimhaut werden ständig nachgebildet. Sogenannte Stammzellen sorgen in diesen Geweben ein Leben lang für Nachschub an neuen Zellen. In anderen menschlichen Organen ist dieses Potenzial jedoch stark eingeschränkt, wie etwa im Gehirn, im Herz und im Auge. Noch dazu bildet der Körper bei größeren Wunden Narbengewebe. So werden entstandene Defekte nur behelfsmäßig repariert, aber nicht regeneriert. Mit zunehmenden Alter der Menschen nimmt die Regenerationsfähigkeit ab, Zellen gehen zu Grunde und die Organfunktionen lassen nach. Die Regenerative Medizin will mithilfe neuartiger Ansätze hier gegensteuern und die Selbstheilungskräfte des Körpers wieder ankurbeln.
Funktionsgestörte Zellen, Gewebe und Organe wiederherstellen
Innerhalb der Biomedizin gehört die Regenerative Medizin zu den Gebieten mit der stärksten Entwicklungsdynamik. Das spiegelt sich auch in den verschiedenen Versuchen wider, dieses Medizinkonzept in Worte zu fassen. Forscher haben sich bisher nicht auf eine offizielle Definition geeinigt. Prinzipiell gilt jedoch: Die Regenerative Medizin ist eine Heilkunst, die auf die Wiederherstellung funktionsgestörter Zellen, Gewebe oder Organe abzielt. Dies geschieht entweder durch Anregung der körpereigenen Regenerations- und Reparaturprozesse oder aber durch biologischen Ersatz in Form von lebenden Zellen oder eigens im Labor gezüchteten Geweben. Das Ziel ist immer gleich: Möglichst den gesunden und funktionalen Originalzustand eines betroffenen Gewebes wiederherzustellen, anstatt es nur behelfsmäßig zu ersetzen und zu reparieren.
Lebende Zellen als zentrales Werkzeug
Lebende Zellen sind dabei das zentrale Werkzeug der Regenerativen Medizin. Sie liefern das Baumaterial für den angestrebten Organersatz und sie bewirken, dass regenerative Prozesse im Körper in Gang gesetzt werden. Auf diese Weise entstehen nicht nur Therapien, sondern auch neuartige Ansätze, um die Diagnostik von Krankheiten zu verbessern oder zellbasierte Testsysteme, um die Wirkung von Medikamenten zu prüfen. Als Forschungsdisziplin ist die Regenerative Medizin in hohem Maße multidisziplinär, denn sie verknüpft Ansätze der Zellbiologie, der Biotechnologie und der Pharmakologie mit Medizintechnik und Materialwissenschaften.
Stammzellen als Materialquelle
Stammzellen sind im Körper die treibenden Kräfte für Entwicklung und Regeneration. Da aus ihnen neue Zellen hervorgehen, sind sie auch die zentrale Materialquelle für die Regenerative Medizin.
Die Herkunft entscheidet über die Einsatzmöglichkeiten
Einfach formuliert ist eine Stammzelle eine Zelle, von der andere Zellen im Körper abstammen. Im Vergleich zu hochspezialisierten Körperzellen sind Stammzellen weniger stark auf eine bestimmte Entwicklungsrichtung festgelegt. Durch Zellteilung sind sie in der Lage, eine sich spezialisierende Tochterzelle und eine Stammzelle zu erzeugen, wodurch sie sich selbst erhalten. Mithilfe von Stammzellen wächst und erneuert sich der Organismus ein Leben lang, Wunden und innere Schäden heilen aus eigener Kraft. Die Medizin versucht, die Heilkraft der Stammzellen zu verstehen und gezielt therapeutisch zu nutzen. Die Herkunft der Stammzellen ist dabei entscheidend für eine mögliche Anwendung. Der Stammzell-Typ entscheidet auch, wie Forscher mit den Multitalenten umgehen dürfen.

Embryonale Stammzellen: zelluläre Ausnahmetalente
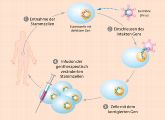
Aus einer befruchteten Eizelle gehen bis zum 8-Zell-Stadium Tochterzellen hervor, die totipotent sind. Jede für sich hat das Entwicklungspotenzial, einen kompletten Organismus aufzubauen. Etwa fünf Tage nach der Befruchtung der Eizelle hat sich der Embryo zu einem kugeligen Zellgebilde entwickelt, der Blastozyste. Aus der inneren Zellmasse der Blastozyste lassen sich embryonale Stammzellen (ES-Zellen) gewinnen. Sie gelten als zelluläre Alleskönner. ES-Zellen sind pluripotent: Sie besitzen also grundsätzlich die Fähigkeit, noch alle Gewebe des menschlichen Körpers bilden zu können (mit Ausnahme des Plazentagewebes). Daher kann sich aus ihnen kein vollständiger Organismus mehr entwickeln, wie das bei totipotenten Zellen der Fall ist. Damit Wissenschaftler mit ES-Zellen arbeiten können, werden sie in Kulturschalen übertragen, die mit einer speziellen Nährlösung gefüllt sind. Hier vermehren sie sich zu mehreren hundert Zellen, die wiederum in neue Kulturschalen überführt werden, so dass aus wenigen embryonalen Stammzellen schließlich Abermillionen entstehen. Bei geeigneter Stimulierung mit einem Cocktail aus Wachstumsfaktoren lassen sie sich in jeden erdenklichen der 200 menschlichen Zelltypen verwandeln. Somit sind ES-Zellen eine schier unerschöpfliche Quelle.
Da zu ihrer Gewinnung Embryonen zerstört werden müssen, wird die Herstellung und Verwendung von humanen ES-Zellen ethisch kontrovers diskutiert. Verschiedene Länder auf der Welt haben politisch und rechtlich unterschiedliche Lösungen für den Umgang mit Embryonen und Stammzellen gefunden. In Deutschland sorgt das Embryonenschutzgesetz für einen strikten Schutz des Embryos und verbietet das Herstellen menschlicher Embryonen zu Forschungszwecken sowie die verbrauchende Embryonenforschung einschließlich der Herstellung von menschlichen ES-Zellen. Zusätzlich regelt das Stammzellgesetz den möglichen Import und die Verwendung von menschlichen ES-Zellen aus dem Ausland. Solche ES-Zelllinien müssen schon vor einem gesetzlich festgelegten Stichtag gewonnen worden sein (1. Mai 2007).
Gewebestammzellen – die Reparaturreserve im Körper
Neben den ES-Zellen sind adulte Stammzellen oder Gewebestammzellen die zweite große Gruppe an Stammzellen.
Sie sind in zahlreichen Geweben von erwachsenen Menschen vorhanden und sitzen dort in speziellen Nischen, um auf ihren Einsatz zu warten. Adulte Stammzellen sind wie ein Reparaturtrupp des jeweiligen Gewebes. Sie sorgen für den nötigen Zell-Nachschub, wenn im Gewebe Zellen absterben und ersetzt werden müssen. So treiben sie die Erneuerung und die Wundheilung an. Adulte Stammzellen sind allerdings in ihrem Entwicklungspotenzial eingeschränkt, sie gelten deshalb als multipotent, weil ihre Abkömmlinge nur noch zu wenigen Zelltypen heranreifen können.
Dank neuester Methoden haben Forscher inzwischen an immer mehr Stellen im Körper die vor Ort zuständigen Gewebestammzellen entdeckt. Das Problem: Viele adulte Stammzellen sind nur mit großem Aufwand zu gewinnen, und ihre Zucht im Labor gestaltet sich oft schwierig. Die Vorteile: Weil sie im erwachsenen Körper vorkommen, sind sie nicht nur ethisch unproblematisch, sondern auch einfacher für therapeutische Zwecke nutzbar. So könnten adulte Stammzellen direkt vom Patienten gewonnen und für eine Behandlung optimiert werden. Ihr Einsatz führt auch nicht zu Abstoßungen durch das Immunsystem.
Eine klinische Anwendung von adulten Stammzellen ist bei der Behandlung von Leukämien bereits seit Jahrzehnten klinische Routine. Durch die Transplantation von immunologisch passenden Stammzellen eines Spenders kann das Blutbildungssystem eines Krebskranken wieder neu aufgebaut werden (mehr...).
| Die Entdeckung der iPS-Zellen... |
...begann im Jahr 2006 in Japan. Wichtige Meilensteine:
November 2007: Molekulare Verjüngungskur: Von menschlichen Körperzellen zu vielseitigen Stammzellen Juni 2008: Sanfte Umprogrammierung der Hautzelle zur Stammzelle Februar 2009: Mit einem Gen zur Stammzelle April 2009: Stammzellen ohne Gentransfer hergestellt Januar 2010: Hautzellen direkt zu Nervenzellen umprogrammiert Oktober 2010: Forscher erzeugen Stammzellen per RNA-Trick September 2011: Pluripotente Stammzellen auf dem Prüfstand |
Für alle weiteren Organe und Gewebe befinden sich Therapien erst in einem experimentellen Stadium oder sie werden in klinischen Studien erprobt. Eine besonders reiche und gut zugängliche Quelle für adulte Stammzellen ist das Knochenmark. Eine weitere Quelle für adulte Stammzellen ist das Nabelschnurblut von Neugeborenen. Hierin finden sich besonders junge, vermehrungsfähige Gewebestammzellen.
Reprogrammieren als alternativer Weg
Weder embryonale noch adulte Stammzellen haben Forscher bislang komplett zufriedengestellt. Aus diesem Grund wird seit langem nach Alternativen gesucht – zum Beispiel, indem Zellen künstlich in eine Art embryonalen Alleskönnerzustand zurückversetzt werden. Diese „Reprogrammierung“ ist japanischen Forschern um Shinya Yamanaka im Jahr 2006 erstmals gelungen (mehr...). Sie wandelten ausgereifte Hautzellen von Mäusen durch gentechnische Tricks so um, dass sie sich wie embryonale Stammzellen verhielten. Das künstlich erzeugte Ergebnis nannten sie induzierte pluripotente Stammzellen (iPS-Zellen). Lediglich ein Cocktail aus den vier Genen namens Oct4, Sox2, c-Myc und Klf4 wurde mithilfe von Viren in die Körperzellen eingeschleust. Dies reichte aus, um in den ausgereiften Zellen eigentlich stillgelegte Erbgutabschnitte zu aktivieren und so das embryonale Genaktivitäts-Programm wieder anzuschalten. Im Jahr 2007 gelang den japanischen Forschern dieselbe Verjüngungskur auch bei menschlichen Hautzellen (mehr...). In der Stammzellforschung haben die Arbeiten von Shinya Yamanaka für einen Paukenschlag gesorgt. Die Erkenntnisse sind so einflußreich, dass der japanischen Forscher bereits 2012 mit dem Medizin-Nobelpreis geehrt wird (mehr...).
iPS-Zellen im Fokus der Forschung
Seither entwickelt sich die Reprogrammierungstechnik in rasantem Tempo weiter. Nun tüfteln Stammzellforscher weltweit an weiteren Verfahren, um die Herstellung von iPS-Zellen effizienter zu machen. Gleichzeitig wird derzeit ausgiebig getestet, wie ähnlich sie in ihren Eigenschaften den natürlichen pluripotenten Stammzellen wirklich sind (mehr...). Den iPS-Zellen wird ein hohes Potenzial zuerkannt, denn die Forschung an ihnen vermeidet den Verbrauch menschlicher Embryonen zur Generierung neuer Stammzelllinien. Da die iPS-Zellen aus winzigen Gewebeproben der Patienten selbst gewonnen werden können, werden aus ihnen hergestellte Zellen bei einer späteren Therapie nicht vom Immunsystem als fremd erkannt. Neuere Studien haben im Tierexperiment ergeben, dass auch von iPS-Zellen abgeleitetes Gewebe in manchen Fällen Immunreaktionen hervorrufen kann, was Forscher vor allem auf die Herstellungsmethoden zurückführen. Ein weiteres Problem: Die verwendeten Körperzellen der Patienten haben durch den Alterungsprozess bereits Mutationen in ihrer Erbinformation angesammelt. Eine neue Entwicklung aus den Stammzelllabors ist die direkte Reprogrammierung. Hierbei ist es gelungen, durch genetische und biochemische Kommandos verschiedene Zelltypen ineinander umzuwandeln, ohne den Umweg über Stammzellen zu gehen. So ist es bereits gelungen, Hautzellen direkt in Nervenzellen umzuwandeln (mehr...).
Wie sich Stammzellen für die Medizin nutzen lassen
Stammzellen bergen ein vielseitiges Potenzial für die Medizin. Biomediziner sehen drei wichtige Anwendungsbereiche:
- Krankheitsmodelle in der Petrischale: Krankheiten können besser erforscht werden, da die betroffenen Zelltypen eines Patienten mithilfe von Stammzellen im Labor herangezüchtet und beobachtet werden können. Forscher können so den Stoffwechsel und die Genaktivität in kranken Zellen untersuchen und die molekularen Ursachen der Krankheiten besser verstehen. Vor allem schwierig zu erforschende Leiden wie die Amyotrophe Lateralsklerose, Krebs oder Schizophrenie werden so besser zugänglich.
- Wirkstoffsuche und Arzneitests: An aus Stammzellen gezüchteten Herz-, Leber- oder Nervenzellen lassen sich chemische Substanzen und Medikamente auf Giftigkeit und andere Nebenwirkungen in hoher Stückzahl testen. So können Pharmahersteller schon früh in der Medikamentenentwicklung aussagekräftigere Schlüsse ziehen und womöglich Tierversuche reduzieren.
- Zelltherapie: Im Labor nachgezüchtete Zellen können in erkrankte Organe von Patienten transplantiert werden, um dort die verlorengegangene Funktion zu ersetzen. Zum einen, so die Hoffnung, setzen sich die Zellen in den betroffenen Geweben fest und bieten strukturellen Ersatz. Auf der anderen Seite geben sie wachstumsfördernde Stoffe an die Umgebung ab und unterstützen so die Regeneration im Gewebe.
Regenerationstechnologien – Von Gewebezucht bis Gentherapie
In der Regenerativen Medizin kommt ein vielseitiger Mix an Methoden aus der Zell- und Molekularbiologie, der Chirurgie sowie den Ingenieurs- und Materialwissenschaften zum Einsatz. Wichtigstes Werkzeug der Regenerativen Medizin sind lebende Zellen, die für den Einsatz in einer Therapie noch mit Wirkstoffen oder Biomaterialien kombiniert werden. Die Zellen werden entweder selbst innerhalb des Körpers zur Erneuerung angeregt oder aber im Labor zu Ersatzgewebe herangezüchtet. Die wichtigsten Regenerationstechnologien sind:
- Gewebeherstellung (Tissue Engineering)
- Zelltherapie
- Anregung körpereigener Regeneration
- Gentherapie
Gewebeherstellung: Das Heranzüchten von einzelnen Zellen und Zellverbänden im Labor ist von zentraler Bedeutung. Sie können einerseits als Ersatzgewebe eingesetzt werden, andererseits aber auch als Modell dienen, um die Funktionsweise von Organen besser zu verstehen. Darüber hinaus eignet sich im Labor hergestelltes Gewebe auch für Medikamententests, um Nebenwirkungen im Modell zu erforschen oder für die Suche nach neuen Wirkstoffen. Die künstliche Herstellung von Geweben in der Kulturschale wird Tissue Engineering genannt. Erstmals 1975 gelang es, menschliche Hautzellen im Labor künstlich zu vermehren. Seitdem macht die Disziplin große Fortschritte. Für einige einfach aufgebaute Ersatzgewebe wie die Oberhaut, Knochen und Knorpel hat die aufwendige Gewebetechnik bereits erste klinische Verfahren hervorgebracht.
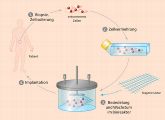
Doch das Züchten von Zellen und ihre Kultivierung im Labor ist ausgesprochen schwierig. Sogenannte biologisch-künstliche (bioartifizielle) Gewebe oder Organe werden in drei Schritten hergestellt: Zellen eines bestimmten Typs werden zunächst gewonnen und vermehrt. Im Labor werden sie auf speziellen Gerüstmaterialien angesiedelt. In Kulturbehältern, den sogenannten Bioreaktoren, werden die Zellen mit den notwendigen Nährstoffen und Sauerstoff versorgt und zu Gewebeverbänden herangezüchtet, bis sie als funktionstüchtiges Transplantat wieder in den Patienten zurückverpflanzt werden können. Die Gewinnung von Zellmaterial ist beim Tissue Engineering der entscheidende Ausgangspunkt. In der Regel werden Zellen verwendet, die vom Patienten selbst stammen. Diese autologen Zellen liefern letztlich Transplantate, die vom Körper nicht abgestoßen werden. Stammen die Zellen von anderen Menschen, spricht man von allogenen Zellen. Entscheidend ist auch das eingesetzte Trägermaterial. Siedelnde Zellen benötigen den Kontakt zu einer solchen Struktur, um tatsächlich wachsen zu können. Dazu werden Trägermaterialien verwendet, die natürlichen oder synthetischen Ursprungs sind. Die Trägersubstanzen werden oft noch zusätzlich mit Biomolekülen oder Wachstumsfaktoren beschichtet, um den darauf siedelnden Zellen so gut wie möglich eine natürliche und reizvolle Umgebung zu bieten. Für eine Vielzahl von Geweben oder Organen entwickeln Bioingenieure derzeit Prototypen und Modelle. Es geht ihnen darum, möglichst dreidimensionale Gewebekulturen zu konstruieren, die wie in der Natur aufgebaut sind.
Zelltherapie: Neben der Gewebezüchtung geht es in der Regenerativen Medizin oft darum, eine Therapie zu entwickeln, die auf lebenden Zellen basiert. Diese werden dabei wie eine Art Arzneimittel verwendet und in die geschädigten Körpergewebe gespritzt. Dort sollen sie sich möglichst in den benötigten Zelltyp entwickeln und sich integrieren, um letztlich die verlorengegangene Funktion wiederherzustellen oder die Regeneration anzukurbeln. Zumindest eine Form der Zellersatztherapie ist zu einem erfolgreichen Routineverfahren in der Medizin geworden: Die Transplantation von Blutstammzellen aus dem Knochenmark. Akute Leukämien zählen zu den aggressivsten aller Krebsleiden. Oft kann den Betroffenen nur mit einer intensiven Chemo- und Strahlentherapie geholfen werden. Dabei werden unweigerlich das blutbildende System und das Immunsystem zerstört. Als Ersatz werden dem Patienten gesunde Blutstammzellen übertragen, sie siedeln sich selbstständig im Knochenmark wieder an und bauen ein völlig neues Blutbildungssystem auf, ebenso ein neues Immunsystem (mehr...). Bei Zellersatztherapien für andere Organe und Gewebe stecken die Biomediziner noch in frühen Stadien der klinischen Forschung und Entwicklung. In Frage für eine Zelltherapie kommen geschädigte Organe mit geringen Selbstheilungsfähigkeiten wie etwa das Herz, das Gehirn oder Knorpel. Adulte Stammzellen aus dem Knochenmark scheinen einen anderen, vielversprechenden therapeutischen Effekt zu haben: In herzinfarktgeschädigtes Gewebe injiziert, setzen sie vorübergehend einen Cocktail an Wachstumsfaktoren frei, der offenbar die Regeneration und die Durchblutung anregen kann.
Anregung der körpereigenen Regeneration : Dieser Ansatz verfolgt das Prinzip Hilfe zur Selbsthilfe. Fachleute sprechen hierbei von „induzierter Autoregeneration“. Durch bestimmte medikamentöse oder medizintechnische Verfahren werden im Körper Heilungs- und Erneuerungsprozesse angeregt und unterstützt. Dazu können biologisch abbaubare Trägermaterialien, die mit bestimmten Wachstums- und Lockstoffen beladen werden, in die geschädigten Gewebe implantiert werden. Für die Regeneration von Nervenfasern werden zum Beispiel sogenannte Leitschienen erprobt. Sie sollen als Lotsen dafür sorgen, dass durchtrennte Nervenbahnen im Körper wieder zueinander finden und miteinander verwachsen. Nach mehreren Monaten werden die Materialien vom Körper abgebaut. Eine weitere Vision, die ohne chirurgischen Eingriff auskommen würde, ist es, Stammzellen im Körper durch Medikamente ganz gezielt anzuregen.
Gentherapie: Als eine völlig andere Regenerationstechnologie gilt die Gentherapie, die wie eine Art Gen-Ersatztherapie funktioniert. Sie zielt darauf ab, defekte Erbanlagen in Körperzellen eines Erkrankten mithilfe von gentechnischen Methoden wieder zu reparieren. Dazu wird in betroffenen Zellen eine gesunde Version des fehlerhaften Gens einschleust.
| Mehr zur Gentherapie |
| News:Stammzellforscher kommen bei Gentherapie voran News:Nervenkrankheit ALD erstmals mit Gentherapie geheilt News:Mit Gentherapie gegen Netzhautdegeneration |
Die Einsatzgebiete für eine Gentherapie liegen vorrangig in der Behandlung von Erbkrankheiten, die auf Defekten in einzelnen Genen beruhen, oder etwa bei Krebs, wo kranke Zellen gezielt zerstört werden sollen. Knackpunkt bei der Gentherapie ist die richtige Auswahl und Entwicklung der sogenannten Genfähre, mit dem der gesunde Erbgutabschnitt in die Zelle eingebracht werden kann. Die wirkungsvollsten Erbmaterial-Einschleuser sind Viren, die diesen Mechanismus sonst dazu brauchen, um ihr Genom im Körper zu verteilen. Während in den Anfängen der Gentherapie-Forschung die Euphorie zunächst sehr groß war, hat sich inzwischen herausgestellt, dass die Verfahren doch sehr kompliziert und risikobehaftet sind. Besonders in den 1990er Jahren gab es einige harte Rückschläge bei der Behandlung von Patienten mit Gentherapien, die in einigen Fällen sogar zum Tod geführt haben. Doch die Forschung hat in den letzten Jahren wieder sehr ermutigende Schritte nach vorne gemacht (mehr...). So wurden zum Beispiel neue Genfähren entwickelt, von denen deutlich weniger Gesundheitsrisiken ausgehen. Auch deutsche Forscher sind äußerst aktiv daran beteiligt, die Gentherapie voranzutreiben (mehr...).
Anwendungsbeispiele: Haut und Herz
Für nahezu sämtlichen Organe und Gewebe des Körpers versuchen Mediziner, regenerative Therapien zu entwickeln oder Modelle für ihre Erforschung im Labor zu entwickeln. Hier sind nur zwei Beispiele aufgeführt. Weitere Anwendungsgebiete stellt die neue BMBF-Broschüre "Regenerative Medizin" vor (mehr siehe rechts).
Haut: Von der Wundauflage bis zur Gewebefabrik
Die Haut ist das größte und regenerationsfreudigste Organ des menschlichen Körpers. Von der Struktur her ist die Haut relativ klar aufgebaut: Sie besteht aus mehreren Zellschichten, die wie Mauersteine übereinander gestapelt sind. Dank dieses vergleichsweise einfachen Aufbaus ist die Züchtung von Hautgewebe im Labor in den vergangenen Jahren zum bisher erfolgreichsten Anwendungsgebiet des „Tissue Engineering“ geworden. Heute hat im Labor nachgebaute und nachgezüchtete Haut zwei bedeutende Anwendungsfelder: In der Medizin ist sie oft die letzte Rettung für Patienten mit schweren Verbrennungen oder chronischen Wunden. In der Kosmetikindustrie wiederum werden die Hautpartien aus der Kulturschale dafür verwendet, neue Substanzen zu testen. Bereits seit Jahren sind bestimmte Hautgewebe kommerziell erhältlich. Dazu gehören meist Modelle der Oberhaut (Epidermis). Sie müssen nicht über Blutgefäße versorgt werden und lassen sich verhältnismäßig leicht im Labor herstellen und züchten. Biotechnologen aus Berlin, Lübeck und München haben dazu in einem vom BMBF geförderten Projekt eine Methode entwickelt, mit der sogar Haut mit Haaren herstellen wollen (mehr…). 94. Folge von biotechnologie.tv: Künstliche Haut aus der Gewebefabrik.Quelle: biotechnologie.tvDerzeit ist die Herstellung solcher Hautmodelle aber noch langwierig, denn sie basiert auf Manufaktur und ist damit teuer. Forscher der Fraunhofer-Institute für Produktionstechnologie (IPT) in Aachen und für Grenzflächen- und Bioverfahrenstechnik (IGB) in Stuttgart haben eine vollautomatischen Produktionsanlage für 3D-Hautmodelle entwickelt. 2011 ging die Gewebefabrik in Betrieb. Pro Monat sollen in der Stuttgarter „Tissue Factory“ bis zu 5.000 daumennagelgroße Hautstückchen vom Stapel gehen (mehr…)
Herz: Schwache Pumpen wieder ankurbeln
Bei einem Herzinfarkt sterben die nicht mehr durchbluteten Gewebebereiche ab und der Herzmuskel hört an dieser Stelle auf zu schlagen. Bisher versuchen Ärzte das geschwächte Pumporgan dann mit Medikamenten in seiner Funktion zu stabilisieren. Um die Durchblutung des unbeschädigten Teils des Herzens zu sichern, werden in vielen Fällen Ersatzadern (Bypässe) rund um das Herz verlegt. Obwohl diese Maßnahmen zu einer deutlichen Verbesserung führen können: Sie beseitigen die Erkrankung nicht dauerhaft, und die Patienten leiden meist an den chronischen Folgen. Um die entstandenen Schäden am Herzmuskel wirklich zu heilen, hilft bislang nur eine Transplantation des Organs, mit allen damit verbundenen Risiken. Biomediziner versuchen daher, die Selbstheilungskräfte der geschwächten Pumpe wieder anzukurbeln. Doch die Regenerationsfähigkeit des Herzens ist bei Menschen stark eingeschränkt. Zwar haben Forscher vor kurzem Stammzellen oder Vorläuferzellen innerhalb des menschlichen Herzmuskels aufgespürt. Sie sind allerdings sehr selten und können von sich aus die zerstörten Muskelpartien nicht angemessen nachbilden. Regenerative Therapien am Herz stützen sich deshalb auf zwei Strategien: Gezüchtete Herzmuskelzellen aus dem Labor sollen als Aufbauhilfe dienen, injizierte Stammzellen sollen die geschwächten Zonen wiederbeleben. Für größere „Ersatzteile“ liefert die Disziplin des Tissue Engineering unter anderem mitwachsende Herzklappen (mehr…). Die Zucht eines kompletten menschlichen Herzens in der Kultur bleibt bislang Utopie.
Stammzelltherapien bei Herzschwäche
Schon seit einigen Jahren beschäftigen sich Forscher damit, Herzinfarkttherapien mit Gewebestammzellen zu testen. So hat die am Klinikum der Universität Frankfurt durchgeführte REPAIR-AMI-Studie gezeigt, dass Herzpatienten von der Gabe körpereigener Stammzellen in die betroffene Herzregion profitieren können (mehr…). Auch Herzmediziner um Gustav Steinhoff von der Klinik für Herzchirurgie der Universität Rostock testen derzeit einen ähnlichen Weg. Am Rostocker Referenz- und Translationszentrum für kardiale Stammzelltherapie (RTC) haben sie ein Verfahren entwickelt, bei dem körpereigene Stammzellen eines Patienten zur Therapie von Herzkrankheiten zum Einsatz kommen. Ende 2009 haben die Mediziner eine groß angelegte Phase III-Studie gestartet, in der bis zu 142 Patienten behandelt werden sollen (mehr…). Diese Studie läuft doppelblind und placebokontrolliert ab, und ist damit die entscheidene Stufe für eine mögliche Zulassung der Therapie.
Neben dem RTC sind noch das Deutsche Herzzentrum in Berlin und die Medizinische Hochschule in Hannover beteiligt. Die Studie wird vom Land Mecklenburg-Vorpommern und vom BMBF unterstützt. Neue Hoffnungsträger für eine zukünftige Herzinfarkttherapie bilden pluripotente Stammzellen, die aus Körperzellen künstlich zurückprogrammiert werden. In einem BMBF-Verbundprojekt untersuchen Kölner Forscher das Potenzial dieser so genannten iPS-Zellen zur Behandlung des Herzinfarktes. Bei Mäusen ist es hier bereits gelungen, aus den künstlichen Stammzellen Herzmuskelzellen heranzuzüchten. Mit einer ähnlichen Strategie erforscht ein Team um Ulrich Martin von der Medizinischen Hochschule Hannover das Potenzial von Stammzellen aus dem Nabelschnurblut von Neugeborenen (mehr…).
Translation: Auf dem Weg in den klinischen Alltag
Die Regenerative Medizin ist noch eine sehr junge Forschungsdisziplin, weshalb die meisten Akteure sich darauf konzentrieren, die wissenschaftliche Basis für künftige Therapien zu legen. Seit Mitte der 2000er Jahre hat dabei ein spürbarer Aufwind eingesetzt: Nicht zuletzt durch einen Technologiesprung, etwa bei Stammzellen und Biomaterialien, sowie verstärkten finanziellen Impulsen der öffentlichen Forschungsförderorganisationen. Während viele Behandlungsansätze noch im Entwicklungsstadium stecken, kommen einige Anwendungen in der Regenerativen Medizin bereits heute Patienten zugute – beispielsweise als Gewebeersatz für Haut oder Knieknorpel.
Auf den Patienten zugeschnittene Therapien sind komplex
Dennoch ist die Translation, also die Umsetzung von erfolgversprechenden Forschungsergebnissen in gut anwendbare klinische Produkte und Verfahren, in der Regenerativen Medizin eine besonders komplexe Angelegenheit. Nicht zuletzt aus diesem Grund ist die Anzahl an Produkten der Regenerativen Medizin noch vergleichsweise gering. Das Problem: Behandlungsformen wie Zelltherapien oder Gewebekonstrukte sind in der Regel auf den einzelnen Patienten ausgerichtet. Das macht jede Behandlung einzigartig und erfordert den Einsatz von viel Zeit, Personal und Hightech. Zudem gilt: Gleiche Zellen von verschiedenen Personen verhalten sich nicht immer gleich, Empfänger reagieren manchmal auf das gleiche Produkt unterschiedlich. Das erschwert die Beurteilung des Nutzens einer Behandlung. Außerdem sind die Zulassungs- und Prüfverfahren für die komplexen Produkte zeitaufwendig und teuer: Schließlich enthalten Präparate oft einen Mix aus lebenden Zellen, biologisch aktiven Wirkstoffen und nicht-biologischen Materialien. Sie alle müssen für sich auf ihre Sicherheit und mögliche Nebenwirkungen hin überprüft werden.
Kleine Unternehmen sind Innovationsmotor
Nicht zuletzt aufgrund dieser Herausforderungen ist die Unternehmenslandschaft in Deutschland bis heute recht überschaubar. Das war auch das Ergebnis einer Bestandsaufnahme, die die Unternehmensberatung Capgemini im Auftrag des Bundesministeriums für Bildung und Forschung (BMBF) im Jahr 2006 durchgeführt hat. Demnach gibt es mehr als 60 Unternehmen in Deutschland, die auf die Regenerative Medizin spezialisiert sind. Traditionell gibt es in Deutschland bedeutende Expertisen im Bereich Tissue Engineering und Zellkultur-Technologien. Bei den Forschungs- und Entwicklungsaktivitäten dominieren Ansätze für Knochen- und Knorpelersatz, für Hautersatz und für Herz- und Lebererkrankungen. Die Studie zeigte aber auch: Deutschland nimmt in der Forschung im internationalen Vergleich eine Spitzenposition ein. Zentren der Technologieentwicklung sind vor allem öffentliche Forschungseinrichtungen wie Hochschulen und Universitätskliniken, aus denen die meisten kleineren und mittleren Unternehmen (KMU) als Ausgründungen entstanden sind.
Fünf Translationszentren bundesweit
Hemmnisse wurden in der damaligen Studie insbesondere bei der Umsetzung von Forschungsergebnissen der Regenerationstechnolgien in Produkte und Therapien gesehen. Weiterer Handlungsbedarf wurde bei der Erstattungspraxis durch die Krankenkassen und den geltenden Zulassungsverfahren für medizinische Produkte sowie den Anforderungen an klinische Studien identifiziert. Die Studie empfahl, die interdisziplinäre Zusammenarbeit voranzutreiben und Akteure aus Kliniken, Biotechnologie-Unternehmen und Behörden besser zu vernetzen. Dazu sollten sogenannte Translationszentren für Regenerative Medizin geschaffen werden. Sowohl das BMBF als auch die Deutsche Forschungsgemeinschaft (DFG) griffen dies auf und begannen – mit Unterstützung durch die jeweiligen Bundesländer – mit dem Aufbau solcher Zentren.
Folgende Standorte werden vom BMBF mit mehr als 70 Millionen Euro gefördert:
- Berlin-Brandenburg Center für Regenerative Therapien (BCRT), seit 2006
- Translationszentrum für Regenerative Therapien (TRM) in Leipzig, seit 2006
- Referenz-und Translationszentrum für kardiale Stammzelltherapie (RTC) in Rostock, seit 2008
Die Deutsche Forschungsgemeinschaft (DFG) fördert zwei Forschungszentren:
- Center for Regenerative Therapies Dresden (CRTD), seit 2006
- Exzellenzcluster „From Regenerative Biology to Reconstructive Therapy“ (REBIRTH) an der Medizinischen Hochschule Hannover, seit 2006
| Mehr auf biotechnologie.de |
Wochenrückblick: 40 Millionen Euro für Zentren in Berlin und Leipzig |
Die Translationszentren bündeln die Kompetenzen aus akademischen und außeruniversitären Forschungseinrichtungen und haben sich zu wichtigen Motoren in der Entwicklung regenerativer Therapien entwickelt. Alle Zentren kooperieren eng mit den jeweiligen Universitätskliniken und Forschungseinrichtungen. So ist es möglich, neue Therapien über verhältnismäßig kurze Wege in Patientenstudien zu testen. Gleichzeitig wurden in den Zentren eigene Abteilungen geschaffen, die sich um die Bewertung, die Entwicklung und die Kommerzialisierung von regenerativen Therapien kümmern. Die Zentren sollen so zu Keimzellen für Firmenausgründungen und zu Partnern für innovationsstarke Unternehmen werden. Ziel ist es, den breiten Einsatz neuer Therapien nachhaltig und in gesundheitsökonomisch sinnvollem Umfang voranzutreiben.
Weitere Standorte für Translationsforschung
Das BMBF unterstützt neben den Translationszentren bundesweit noch weitere Netzwerke und Standorte, die die Regenerative Medizin in die Anwendung bringen wollen. Dazu zählen:
- die Gesundheitsregion „REGiNA“ (Regenerative Medizin in der Neckar-Alb Region) ging 2009 als Gewinner des BMBF-Wettbewerbs „Gesundheitsregionen der Zukunft“ hervor und wird bis 2013 mit 7,5 Millionen Euro gefördert (mehr...). REGiNA bündelt 16 Teilprojekte und 30 Partner aus Forschung, Klinik und regionalen Unternehmen, um regenerationsmedizinische Produkte und Behandlungsmethoden zu erforschen und pilotartig in die Gesundheitsversorgung einzuführen.
- die HI-STEM gGmbH, die 2008 mit Mitteln der privaten Dietmar-Hopp-Stiftung und des Deutschen Krebsforschungszentrums DKFZ in Heidelberg gegründet wurde. HI-STEM bündelt die Aktivitäten von Heidelberger Kliniken und Forschungseinrichtungen zur Erforschung von Krebsstammzellen. HI-STEM ist ein zentraler Partner des Spitzenclusters „Zellbasierte und Molekulare Medizin“ in der Biotech-Region Rhein-Neckar (BioRN), der 2008 den mit 40 Millionen Euro dotierten Spitzencluster- Wettbewerb des BMBF gewonnen hat (mehr...). HI-STEM erhält aus diesem Topf rund 6 Millionen Euro.
| Deutsch-kalifornische Kooperation |
Förderbeispiel:Mit Stammzellen das optimale Parkinson-Medikament finden |
Internationale Kooperationen
Um die Umsetzung regenerativer Therapien voranzutreiben, soll auch die internationale Zusammenarbeit der jeweiligen weltweit führenden Experten und Translationszentren gefördert werden. Dazu hat das BMBF bilaterale Abkommen mit Forschungsfördereinrichtungen in den USA im Bereich der Regenerativen Medizin geschlossen. Seit Oktober 2009 existiert ein Memorandum of Understanding mit dem California Institute for Regenerative Medicine (CIRM), der größten Fördereinrichtung für Stammzellstudien weltweit (mehr...).
Die Vereinbarung ermöglicht deutschen Forschern oder Forschungseinrichtungen die Teilnahme an Ausschreibungen des CIRM im Rahmen amerikanisch-deutscher Kooperationen. Bisher gab es fünf Förderrunden, in denen sich Teams bewerben konnten, sieben Projekte sind bisher gestartet.