Wochenrückblick KW 10
Neue Erkenntnisse zur Evolution der Proteinbiosynthese
Forscher an der Universität Wittenberg haben eine Reaktion in einem Proteinbiosynthese-Enzym entschlüsselt, die so vermutlich schon seit Millionen Jahren stattfindet.
Die als Very Important Paper bei der Fachzeitschrift Angewandte Chemie (2012, Online-Vorabpublikation) veröffentlichte Entdeckung betrifft das Enzym TobZ (Tobramycin 6´´- O-Carbamoyltransferase), das für die Biosynthese des Antibiotikums Tobramycin entscheidend ist. Tobramycin wird bei Augenentzündungen angewandt. Ursprünglich wollten die Forscher um Milton T. Stubbs von der Martin-Luther-Universität Halle-Wittenberg lediglich die dreidimensionale Struktur des Enzyms klären. Dazu wurde das Enzym kristallisiert und mit Röntgenstrahlen durchleuchtet. „TobZ besteht aus zwei Proteindomänen, die jeweils ein aktives Zentrum besitzen“, erläutert der Biotechnologe Stubbs. „Beide Zentren liegen innerhalb einer Reaktionskammer, die man sich wie einen Kochtopf vorstellen kann.“ Dabei fiel den Forschern auf, dass das Enzym den Zellkraftstoff ATP für seine katalytische Tätigkeit verwendet.
| Mehr auf biotechnologie.de |
News: Neue Testverfahren: Zellfreie Eiweiß-Synthese im Fokus Menschen: Marina Rodnina: Blick auf die Entstehung molekularer Arbeitstiere |
„Das kam uns in bisschen verschwenderisch vor“, so Stubbs weiter. „Als ob man viel Energie verwendet für die Produktion von Papier, nur um es dann gleich zu verbrennen, damit einen das Feuer wärmt.“Wie die Forscher herausfanden, wird das ATP aber verwendet, um ein Zwischenprodukt von einer Reaktionskammer in die nächste zu befördern – eine Reaktion, die in jedem Organismus zu finden ist. In anderen Organismen wird dabei der Vorläufer der Transfer-RNA (tRNA) weitergeleitet. Stubbs und seine Kollegen schlussfolgern daraus, dass TobZ-ähnliche Enzyme bereits sehr früh in der Evolution entstanden sind. TobZ sein eine Art „molekulares Fossil“ an dessen Beispiel man sehen könne, dass die Energieeffizienz für bestimmte Reaktionen offenbar einmal eher unwichtig gewesen sei. „Diese Enzyme sind fundamental für die Protein-Herstellungs-Maschinerie und erlauben uns einen Blick zurück zur Entstehung des Lebens“, resümiert Stubbs.
©biotechnologie.de/ck
Die wichtigsten Nachrichten aus der Biotech-Branche
- Apogenix: Phase II-Studie erfolgreich
- Molekulare Tarnkappe für Bakterien
- DKFZ setzt auf Systembiologie
- Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie
- Antibiotika im Schweiß
Apogenix: Phase II-Studie erfolgreich
Das Heidelberger Pharma-Unternehmen Apogenix hat eine Phase II-Studie mit dem Antikörper-Medikament APG101 erfolgreich beendet.
Wie das Unternehmen am 9. März bekannt gab, hat die Studie mit dem antikörperbasierten Fusionsprotein APG101 den primären Endpunkt erreicht. Die Arznei soll zur Behandlung einer besonders aggressiven Form eines Hirntumors eingesetzt werden. Merkmal für einen erfolgreichen Abschluss der Studie war, dass die Patienten sechs Monate überlebten, ohne dass sich der Tumor vergrößert oder metastasiert. Als zweitrangige Ziele wurden in der Studie die Verlängerung der Überlebenszeit, die Sicherheit und Verträglichkeit von APG101 sowie Parameter zur Lebensqualität der Patienten erfasst. Wie Apogenix mitteilte, wurde das Studienziel erreicht, den Prozentsatz von Patienten, bei denen das progressionsfreie Überleben bei sechs Monaten lag zu verdoppeln.
| Mehr auf biotechnologie.de |
Förderbeispiel: Innovative Therapieverfahren: Gehirntumore vom Wuchern abbringen Wochenrückblick: 8,8 Millionen Euro für Apogenix |
Nebenwirkungen bei der Medikamenteneinnahme habe man nicht bemerkt, doch eine vollständige Auswertung der zweitrangigen Aspekte stehe noch aus. „Angesichts der Ergebnisse unserer kontrollierten Wirksamkeitsstudie sind wir zuversichtlich, Patienten mit APG101 in einer schwierigen Phase der Erkrankung maßgeblich helfen zu können“, sagte Harald Fricke, medizinischer Leiter bei der Apogenix GmbH, und kündigte an: „Dank der Unterstützung unserer Investoren werden wir das therapeutische Potential von APG101 bei weiteren Krebserkrankungen evaluieren.“ Apogenix, eine Ausgründung des Heidelberger Krebsforschungszentrums, entwickelt neuartige Proteinwirkstoffe für die Behandlung von Krebs- und Entzündungserkrankungen auf der Basis einer zielgerichteten Modulation der Apoptose (des programmierten Zelltods) oder der Blockade des Wachstums von Tumorzellen. Erst Anfang des Jahres hatte Apogenix 7,5 Millionen Euro bei seinen Investoren eingesammelt und zusätzlich 2,3 Millionen Euro Fördergelder beim Bundesforschungsministerium eingeworben. Derzeit wird APG 101 auch noch zur Behandlung des Myelodysplastischen Syndroms (MDS) entwickelt. Dabei kommt es zu Blutbildungsstörungen, so dass keine reifen, funktionstüchtigen Blutkörperchen mehr entstehen.
© biotechnologie.de/bk
Die wichtigsten Nachrichten aus der Biotech-Branche
- Neue Erkenntnisse zur Evolution der Proteinbiosynthese
- Molekulare Tarnkappe für Bakterien
- DKFZ setzt auf Systembiologie
- Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie
- Antibiotika im Schweiß
Molekulare Tarnkappe für Bakterien
Minimale Veränderungen an einzelnen Molekülen tarnen Bakterien vor den Fresszellen des Immunsystems.
Wie Molekularbiologen der Universitäten Mainz und Tübingen im Journal of Experimental Medicine (2012, Online-Vorabpublikation) beschreiben, überlistet das Darmbakterium Escherichia coli (E. coli) mit dieser molekularen Tarnkappe die toll-like-Rezeptoren (TLR) an den Fresszellen des Immunsystems. TLR befinden sich an einer bestimmten Art von Immunzellen, den Fresszellen (Makrophagen). Verfangen sich Teile der Erbinformation von Viren oder Bakterien daran, lösen sie eine Signalkette aus, die das Immunsystem in Alarmbereitschaft versetzt. In der aktuellen Arbeit befassten sich die Arbeitsgruppen um den Infektiologen Alexander Dalpke am Universitätsklinikum Heidelberg und den Biochemiker Mark Helm von der Universität Mainz mit dem TLR-7, der bis dato als Detektor für virale Nukleinsäuren galt. Die bakterielle Tarnkappe entdeckten die Forscher bei Tests mit Transfer-RNA. Obwohl sie wie die Transfer-RNA anderer Bakterienarten an den Rezeptor bindet, reagiert die Immunzelle nicht.
| Mehr auf biotechnologie.de |
Die Wissenschaftler zeigten: Verantwortlich dafür ist eine einzige chemische Modifikation (Methylierung) am Grundgerüst des Moleküls, die vermutlich ursprünglich der Stabilisierung dient. Ohne diese Modifikation löst das Bakterienmolekül den Alarm aus, mit Veränderung nicht. „Es ist bemerkenswert, dass eine einzelne Methylierung bei einem sehr geringen Anteil der in Bakterien vorhandenen Transfer-RNAs bereits ausreicht, um die Aktivierung der Immunzelle zu verhindern“, so Dalpke. Jetzt untersuchen die Forscher, wie und wann die Bakterien die Tarnkappe einsetzen. „Je nachdem, wo wir fündig werden, können wir mehr darüber sagen, ob die Modifikation bei besonders gefährlichen Bakterien oder eher bei ungefährlichen oder sogar nützlichen Bakterien vorkommt“, sagt Dalpke. E. coli wäre ein Beispiel für letztere: Die Bakterien leben symbiotisch im Darm und unterstützen die Verdauung – die Tarnkappe verhindert, dass der Körper sie abbaut.
© biotechnologie.de/ck
Die wichtigsten Nachrichten aus der Biotech-Branche
- Neue Erkenntnisse zur Evolution der Proteinbiosynthese
- Apogenix: Phase II-Studie erfolgreich
- DKFZ setzt auf Systembiologie
- Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie
- Antibiotika im Schweiß
DKFZ setzt auf Systembiologie
Am Deutschen Krebsforschungszentrum (DKFZ) Heidelberg entstehen drei neue systembiologische Forschungsverbünde.
Sie sollen helfen, die komplexen Vorgänge bei der Krebsentstehung aufzuklären. Wie das DKFZ am 6. März bekannt gab, fördert das Bundesforschungsministerium die Projekte LungSys-II, CancerEpiSys und MYC-NET in den kommenden drei Jahren mit insgesamt neu Millionen Euro.
| Mehr auf biotechnologie.de |
Förderung: Systembiologie in Deutschland hat Modellcharakter Statistik: Systembiologie im internationalen Vergleich |
Die Forscher wollen eine Kombination experimenteller Messverfahren und mathematischer Modelle nutzen, um die systembiologischen Aspekte der Krebserkrankung erforschen. Der Forscherverbund MYC-NET untersucht, wie Krebszellen kindlicher Hirntumore resistent gegen Chemo- und Strahlentherapien werden. Insbesondere soll zum ersten Mal unter dem Mikroskop beobachtet werden, wie Krebszellen auf eine Chemotherapie reagieren. Die neuen Erkenntnisse zur Variabilität des Zellverhaltens und zur Selektion therapieresistenter Krebszellen sollen langfristig neue Therapieoptionen eröffnen.
Beim Projekt EpiCancerSys werden epigenetische Veränderungen bei der chronischen lymphatischen Leukämie untersucht. „Wir wollen epigenetische Zusammenhänge herausfiltern, die für die Entstehung und Bekämpfung der chronischen lymphatischen Leukämie entscheidend sind“, erläutert Karsten Rippe, einer der Projektkoordinatoren. Insbesondere soll geklärt werden, wie epigenetisch wirksame Krebsmedikamenten, auf diese Faktoren Einfluss nehmen können.
Der Forscherverbund LungSys-II beschäftigt sich mit Lungentumoren. Um eine durch die Chemotherapie induzierte Blutarmut zu behandeln, erhalten Lungenkrebs-Patienten das Medikament Erythropoietin (Epo), das die Bildung roter Blutkörperchen ankurbelt und damit die Versorgung mit Sauerstoff sicherstellt. Ein entsprechender Rezeptor wurde aber auch auf verschiedenen Tumorzellen nachgewiesen, so dass das Medikament deren Wachstum fatalerweise ebenfalls ankurbelt. Mit systembiologischen Methoden soll das Zusammenspiel von Tumorwachstum und Blutplättchenbildung nun genauer untersucht werden, um die Behandlung von Lungenkrebspatienten mit Erythropoietin sicherer zu machen.
© biotechnologie.de/bk
Die wichtigsten Nachrichten aus der Biotech-Branche
- Neue Erkenntnisse zur Evolution der Proteinbiosynthese
- Apogenix: Phase II-Studie erfolgreich
- Molekulare Tarnkappe für Bakterien
- Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie
- Antibiotika im Schweiß
Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie
Positiv geladene Sternpolymere mit einem magnetischen Kern könnten als DNA-Vehikel die Gentherapie voranbringen.
Wie ein Forscherteam der Universität Bayreuth in der Online-Ausgabe der Fachzeitschrift Biomacromolecules (2012, Online-Vorabpublikation) berichtet, zeichnen sich die im gleichen Institut vor einem halben Jahr entwickelten Sternpolymere durch eine außerordentlich hohe Gentransfer-Effizienz aus. Bisher wurden dafür vor allem Viren benutzt. Das Forscherteam um die Bioprozesstechnikerin Ruth Freitag und den Molekularchemiker Axel Müller hatten große sternförmige Polymere entwickelt, mit deren Hilfe Erbinformationen auch in solche Zellen transportiert werden konnten, deren Erbgut bisher nur mit Hilfe von Viren verändert werden konnte. Es konnten sogar Zellen verändert werden, die sich nicht teilen – früher eine Voraussetzung für den Gentransfer. Jetzt ist es den beiden Wissenschaftlern gelungen, die Sternpolymere mit einem magnetischen Kern auszustatten.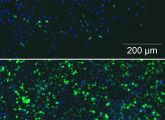

Mehr auf biotechnologie.de |
News: Gentherapie im Reifeprozess |
Ebenso wie die früher erprobten Sternpolymere können auch die magnetischen Sterne Gene in verschiedene lebende Zellen einschleusen, zeigen dabei jedoch eine maßgeblich höhere Effizienz. „Der Anteil der Zellen, in deren Kerne die gewünschte Erbinformation eingedrungen ist, übersteigt deutlich den Anteil, den wir bislang bei Transfektionen mit Polyethylenimin (PEI) erreicht haben.“ Das Molekül gilt in der Biotechnologie bis heute als „Goldstandard“ bei der Transfektion von Zellen und kommt daher weltweit in gentechnischen Verfahren zum Einsatz. Abgesehen von ihrer höheren Effizienz als DNA-Vektoren haben die magnetischen Bayreuther Sternpolymere noch einen weiteren Vorzug: Sie behalten ihre magnetische Wirkung auch innerhalb der Zellen. Um die erfolgreich veränderten Zellen aus der Gesamtprobe herauszuziehen, genügt den Wissenschaftlern zufolge ein handelsüblicher starker Magnet.
© biotechnologie.de/ck
Die wichtigsten Nachrichten aus der Biotech-Branche
- Neue Erkenntnisse zur Evolution der Proteinbiosynthese
- Apogenix: Phase II-Studie erfolgreich
- Molekulare Tarnkappe für Bakterien
- DKFZ setzt auf Systembiologie
- Antibiotika im Schweiß
Antibiotika im Schweiß
Das im menschlichen Schweiß enthaltene Peptid Dermcidin wehrt Infektionen auf der Haut nach Art eines Antibiotikums ab.
Das berichten Forscher der Universität Tübingen und des Karlsruher Instituts für Technologie (KIT) in der Fachzeitschrift Journal of Biological Chemistry (2012, Online-Vorabveröffentlichung).
| Mehr auf biotechnologie.de |
Menschen: Tilo Biedermann: Geht unter die Haut Förderporträt:Biotech-Kino: Tödliche Viren und künstliche Haut |
Demnach bildet das Peptid Ionenkanäle in der Membran der Bakterien, die den Organismus langsam absterben lassen. Dermcidin ist ein Bestandteil des natürlichen Abwehrsystems der Haut, die nicht nur eine physische Barriere gegen Fremdkörper bildet, sondern über die Schweißdrüsen auch chemische Abwehrstoffe absondert. Einer dieser Stoffe ist das antimikrobielle Peptid Dermcidin. Es wird mit dem Schweiß auf der Hautoberfläche verteilt, bleibt im Säureschutzmantel der Haut stabil und wirkt wie ein natürliches Breitbandantibiotikum gegen Keime wie Kolibakterien, Staphylokokken und den Hefepilz Candida albicans. Auf der Haut wird Dermcidin in verschiedene Fragmente gespalten, unter anderem das amphiphile Peptid DCD 1L. Dessen Funktion hat das Team um die Biologinnen Birgit Schittek und Anne Ulrich genauer untersucht. DCD 1L ist nicht nur ein außergewöhnlich langes Molekül, sondern auch besonders gut an das salzig-saure Milieu der Haut angepasst. Vor allem aber überraschte die Forscher, dass das Molekül ähnlich funktioniert wie ein Antibiotikum, es setzt sich in der Bakterienhülle fest und bildet dort winzige Löcher. Durch diese Löcher gelangen Ionen in das Innere des Bakteriums, die einen Ladungsausgleich herbeiführen und so das Spannungsgefälle zerstören, auf dem der gesamte Bakterienstoffwechsel basiert. Das Bakterium stirbt. Den Forscher gelang so erstmals, ein molekulares Modell für die antimikrobielle Wirkung eines anionischen Peptids im menschlichen Schweiß zu erstellen. Körpereigene Antibiotika wie DCD 1L werden auch im Hinblick auf die Hauterkrankung Neurodermitis erforscht. Bei den Betroffenen der vermehrten Hautinfektionen befand sich eine unterdurchschnittliche Konzentration von DCD 1L im Schweiß.
© biotechnologie.de/ck
Die wichtigsten Nachrichten aus der Biotech-Branche
- Neue Erkenntnisse zur Evolution der Proteinbiosynthese
- Apogenix: Phase II-Studie erfolgreich
- Molekulare Tarnkappe für Bakterien
- DKFZ setzt auf Systembiologie
- Sternpolymere eröffnen neue Möglichkeiten in der Gentherapie