Tegenero-Fall aufgerollt: Forscher klären Wirkmechanismus des Antikörpers auf
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
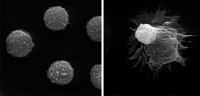
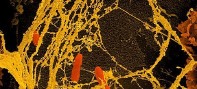
- Göttinger Forscher haben an Versuchen mit Ratten die Wirkungsweise des Antikörpers entschlüsselt, den die Biotech-Firma Tegenero 2006 einst als Therapeutikum entwickeln wollte. Quelle: Universitätsmedizin Göttingen
04.04.2008 -
Auf TGN1412 ruhten große Hoffnungen: Die Würzburger Biotechnologie-Firma Tegenero wollte mit diesem Antikörper Patienten mit Rheumatoider Arthritis und Leukämie behandeln. Ein erster Test in der Klinik ging im Jahr 2006 jedoch gründlich schief. Innerhalb weniger Stunden nach der Injektion erlitten die gesunden Probanden multiples Organversagen, ihr Immunsystem lief Sturm. Die entscheidende Frage lautet seitdem: Hätten vorherige Tests eine solche Reaktion vorhersehen können? Eine abschließende Antwort gab es darauf bislang nicht. Nun haben Göttinger Immunologen um Holger Reichardt von der Universitätsmedizin Göttingen erstmals den eigentlichen Wirkmechanismus des Antiköpers aufgeklärt - anhand des Tiermodells, das auch Tegenero verwendet hat. Wie die Forscher im Fachmagazin The Journal of Clinical Investigation (2008, Vol. 118, S. 1405) berichten, verhält sich der Antikörper offenbar wie ein zweischneidiges Schwert und löst zwei ganz unterschiedliche Reaktionswellen im Körper aus.
TGN1412 war der einzige fortgeschrittene Wirkstoffkandidat des Biotech-Unternehmens Tegenero, das im Jahr 2000 vom Immunologen Thomas Hünig gemeinsam mit Thomas Hanke aus der Universität Würzburg ausgegründet wurde. Der monoklonale Antikörper sollte spezielle Aufpasser-Zellen der Immunabwehr (regulatorische T-Zellen) aktivieren, um auf diese Weise Patienten zu behandeln, die an Krankheiten wie Rheumatoide Arthritis, Multiple Sklerose oder Leukämie leiden. Ihre Erkenntnisse stützten die Forscher auf zahlreiche Versuchen mit Ratten und Makaken. Diese zeigten, dass ein solcher Antikörper tatsächlich die gewünschten Immunzellen aktivieren kann, ohne offenbar auffällige Nebenwirkungen auszulösen. (2005, The Journal of Experimental Medicine Vol. 202, S. 445-455)
| Antikörper... |
... sind normalerweise Bestandteil der körpereigenen Immunabwehr und können spezifisch an andere Biomoleküle binden. Diese Eigenschaft soll in der Therapie gezielt genutzt werden. |
Auf welche Weise der Antikörper die Produktion der regulatorischen T-Zellen im Detail ankurbelt, wussten die Wissenschaftler damals nicht. Dies ist aber längst keine unübliche Herangehensweise in der Medikamentenentwicklung, viele Therapien nehmen so ihren Anfang und werden klinisch geprüft. Auch die Zulassungsbehörden hatten keine Bedenken für erste Tests am Menschen. Sowohl die britische Medicines and Healthcare Products Regulatory Agency (MHRA) als auch das in Deutschland zuständige Paul-Ehrlich-Institut (PEI) hatten der klinischen Prüfung von TGN1412 an gesunden Probanden im Jahr 2006 grünes Licht gegeben.
Verhängnisvollerweise handelte es sich bei TGN1412 allerdings nicht um irgendeinen Antikörper, sondern um einen sogenannten Superagonisten. Darunter verstehen Experten solche Antikörper, die so konstruiert sind, dass sie eine sehr starke Bindung mit dem Oberflächenrezeptor eingehen, auf den sie gerichtet sind. Dies wiederum soll zu einer möglichst starken Reaktion führen.
| Superagonistische Antikörper... |
| ... sind Antikörper, deren Bindung an einen Rezeptor so fest ist, dass eine sehr starke Reaktion ausgelöst wird. |
Bei TGN1412 hatte der Antikörper den Rezeptor CD28 im Visier, eine zentrale Schaltstelle im Immunsystem, die die Forscher gezielt für therapeutische Zwecke ausnutzen wollten. Beim Menschen löste dieser Antikörper dramatische Folgen aus: Kurz nach der Injektion lief das Immunsystem der sechs gesunden Probanden regelrecht Sturm, massenweise entzündungsfördernde Substanzen (Zytokine) wurden ausgeschüttet und lösten multiples Organversagen aus (mehr...). Nur mit Glück konnte der Tod der Testteilnehmer verhindert werden.
Zentrale Frage: Wie aussagekräftig sind Tiermodelle für den Menschen?
Diese Ergebnisse lösten damals in Wissenschaft und Wirtschaft große Aufregung aus und rückten ein grundsätzliches Dilemma der Medikamentenentwicklung in den Mittelpunkt: Wie aussagekräftig sind Tiermodelle für eine Vorhersage beim Menschen? Aus wissenschaftlicher Sicht sind sie unerlässlich, um Wirkmechanismen im lebenden Organismus zu überprüfen, die zuvor in Zellkulturen entdeckt worden waren. Eine Alternative dazu gibt es nicht.
| Klinische Studien |
| Bevor ein neues Medikament für den Markt und für die Anwendung beim Menschen zugelassen wird, muss es mehrere Prüfungen durchlaufen. Dabei werden drei Stufen unterschieden. In der ersten klinischen Phase (Phase I) wird die generelle Verträglichkeit an gesunden Menschen getestet. In der zweiten (Phase II) wird der Wirkstoff an eine kleine Patientengruppe verabreicht, die an der Krankheit leidet, gegen die das künftige Medikament helfen soll. In der dritten und letzten Phase (Phase III) soll der Wirkstoff schließlich seine Wirksamkeit an einer großen Patientenzahl beweisen. |
Dennoch lassen sich viele Ergebnisse aus Tierversuchen nicht in Gänze auf den Menschen übertragen. Die Gründe dafür sind vielschichtig. Zum einen kann überhaupt nur eine abgewandelte Form des eigentlichen Medikamentenkandidaten im Tier verwendet werden, um dort keine unerwünschte Immunreaktion auszulösen.
Im Fall von TGN1412 wurde etwa bei den Ratten das Antikörperpendant JJ316 verwendet. Zum anderen handelt es sich bei Tieren aber auch um ein Immunsystem, das nicht eins-zu-eins wie das des Menschen funktioniert. So besitzen Makaken zwar einem dem Menschen sehr ähnliches Immunsystem, aber kleine Unterschiede bestehen. So ist beispielsweise beim CD28-Rezeptor der Makaken die Aminosäuresequenz an einer entscheidenden Bindungsstelle anders aufgebaut. Dies wiederum – so wissen Forscher heute – ist auch der Grund dafür, dass das Immunsystem der Affen ohne große Nebenwirkungen auf den Tegenero-Antikörper reagierte und dort, anders als beim Menschen, kein Zytokin-Sturm ausgelöst wurde. Jedes Tiermodell ist also nur eine Annäherung an den Menschen, ohne diese Nähe hundertprozentig garantieren zu können. Die Herausforderung bei jeder Medikamentenentwicklung besteht darin, vor einem Test am Menschen die bestmögliche Annäherung zu finden. Der Fall Tegenero machte deutlich: Selbst klitzekleine Abweichungen können dramatische Folgen haben.
Aus dem Fall Tegenero gelernt
Die Regulierungsbehörden haben aus dem Fall Tegenero gelernt und die Hürden für Medikamentenkandidaten mit unbekanntem Wirkmechanismus inzwischen deutlich höher angesetzt. Zudem gibt es eigene Regeln für „Hochrisikowirkstoffkandidaten“ wie TGN1412 einer war. Denn auch trotz der Unzulänglichkeiten von Tier- oder Zellkulturversuchen gibt es Mögllichkeiten, auf Unregelmäßigkeiten zu stoßen, wie bei TGN1412 im Nachhinein gezeigt werden konnte. So haben britische Forscher um Stebbings (2007, Journal of Immunology Vol. 179, S. 3325-3331) allein auf der Basis von Zellkulturen mit menschlichen Zellen – einem Standardversuch in der immunologischen Grundlagenforschung – gezeigt, dass TGN1412 eine starke Zytokin-Aktivierung zur Folge hat. Und nur wenige Monate nach dem fehlgeschlagenen klinischen Test in London haben niederländische Autoren Ähnliches anhand von gentechnisch veränderten Mäusen nachgewiesen, die mit einem menschlichen Immunsystem ausgestattet wurden (2006, Blood, Vol. 108, S. 238-45).
Göttinger Forscher klären Wirkmechanismus von Tegenero-Antikörper
Die neue Veröffentlichung der Göttinger Forscher ermöglicht nun erstmals, den Wirkmechanismus hinter TGN1412 zu verstehen. Sie bedienten sich dabei dem gleichen Tiermodell, das auch Tegenero benutzt hatte und analysierten die Wirkung des superagonistischen Antikörpers JJ316 bei Ratten. Reichardt ist der Fall Tegenero wohl bekannt, schließlich war er neben Firmengründer Thomas Hünig sehr lange ebenfalls Professor am Lehrstuhl für Immunologie der Universität Würzburg und wechselte erst nach dem Tegenero-Fall nach Göttingen. Wie er nun im Fachmagazin the Journal of Clinical Investigation (2008, Vol. 118, S. 1405) berichtet, löst der Antikörper offenbar eine zweistufige Reaktion aus. So stellten die Wissenschaftler mithilfe der Videomikroskopie in den Ratten fest, dass die Immunzellen innerhalb der ersten 24 Stunden nach Gabe des Antikörpers nahezu zum Stillstand kamen, sich in der Milz sowie in den Lymphknoten ansammelten und aus dem Blut sowie anderen Organen (Leber, Lunge) verschwanden.
| Mehr Informationen |
Pressemitteilung der Universiätsmedizin Göttingen: hier klicken |
Die Forscher erklären diesen Stillstand durch verstärkte Adhäsionsfähigkeiten der Immunzellen: Sie blieben also in den Organen quasi hängen, produzierten dort auch Zytokine, doch diese wurden nicht ins Blut freigesetzt – und lösten dort, anders als beim Menschen zu beobachten war, keinen Zytokin-Sturm aus. Nach spätestens zwei Tagen konnten die Forscher schließlich die eigentlich gewünschte Reaktion beobachten, nämlich die verstärkte Aktivierung der regulatorischen T-Zellen.
Für Tegenero kommen diese Erkenntnisse zu spät. Die Firma musste nach dem Desaster der klinischen Studie im Oktober 2006 Konkurs anmelden. Allerdings wurden die Überreste von einem russischen Investor aufgekauft. Dieser lässt nun weiter nach immunmodulierenden Medikamenten suchen - unter dem Namen Theramab GmbH in Würzburg. Als Geschäftsführer agiert Dr. Sergej Chuvpilo, einst Mitglied eines Graduiertenkollegs unter Tegenero-Gründer Hünig an der Universität Würzburg, später wissenschaftlicher Mitarbeiter am Pathologischen Institut.