Wochenrückblick KW 04
Rückblick auf Kalenderwoche 4
Für den Zeitraum vom 25. bis 31. Januar 2011 hat biotechnologie.de für Sie die wichtigsten Nachrichten aus der Biotech-Branche zusammengestellt.
Schnelles Einsatzkommando des Immunsystems
Erstmals konnten Forscher direkt beobachten, wie das Immunsystem innerhalb kürzester Zeit massenhaft mobilisiert wird.
Videosequenzen zeigen, wie neutrophile Granulozyten der körpereigenen Abwehr massenweise aus dem Knochenmark ausgeschwemmt werden. Veröffentlicht wurden die Ergebnisse des internationalen Forscherteams um Matthias Gunzer vom Institut für Molekulare und Klinische Immunologie der Otto-von-Guericke-Universität Magdeburg jetzt im Fachblatt Blood (Online-Vorabveröffentlichung, 11. Januar 2011).
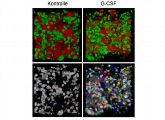

Neutrophile Granulozyten entstehen aus Stammzellen des Knochenmarks. Gelangen Krankheitserreger in den Körper, wird der Wachstumsfaktor G-CSF (Granulocyten-Koloniestimulierender Faktor) ausgeschüttet. Dadurch werden die Granulozyten mobilisiert, mit dem Blutstrom wandern sie in das infizierte Gewebe und bekämpfen die Erreger. Mediziner benutzen eine gentechnisch hergestellte Variante von G-CSF, um die nach einer Chemotherapie zerstörte Immunabwehr möglichst schnell wieder zu aktivieren. Wie genau das funktioniert "konnte bislang leider nicht bis ins Detail geklärt werden“, sagt Gunzer.
| Mehr auf biotechnologie.de |
Mit Hilfe moderner Bildgebungstechniken wie der sogenannten Zwei-Photonen-Mikroskopie gelang es Gunzer und seinem Team nun erstmals, die Mobilisierung im lebenden Organismus zu filmen. „Wir konnten zeigen, dass die neutrophilen Granulozyten normalerweise relativ ruhig im Knochenmark umherlaufen. Sobald aber G-CSF eintrifft, werden sie rasend schnell und beginnen, massiv in die Blutgefäße, die reichlich im Knochen vorhanden sind, einzuwandern“, sagt Gunzer. Die Mobilisierung erfolgt über eine komplexe Signalkaskade, die nicht nur dazu führt, dass die Granulozyten beweglich werden, sondern ihnen auch dabei hilft, gezielt in infiziertes Gewebe einzuwandern.
BMBF fördert deutsche Beteiligung am 1000-Epigenome-Projekt
Mit einer neuen Förderinitiative will das Bundesministerium für Bildung und Forschung (BMBF) deutschen Forschungsverbünden die Teilnahme am Internationalen Humanen Epigenom-Projekt.
Das „International Human Genome Consortium“ (IHEC) - im Februar 2010 gegründet - will in den kommenden Jahren tausend epigenetische „Fingerabdrücke“ von jedem Zelltypen des Menschen anfertigen (mehr…). Das Epigenom besteht aus unzähligen kleinen chemischen Markierungen auf der DNA und den sie stützenden Proteinen, die bestimmen, nach welchem Muster Gene im Zellkern überhaupt aktiv werden.
Mit dem neuen Fördertopf will das BMBF „eine maßgebliche deutsche Beteiligung" am internationalen Großprojekt IHEC ermöglichen. Dabei werden thematisch fokussierte, interdisziplinäre Verbünde bei der Epigenom-Kartierung über einen Zeitrahmen von bis zu fünf Jahre finanziell unterstützt. Bevorzugt werden Projekte mit funktionellen Analysen, die Regulationsmechanismen mit potentieller klinischer Relevanz bei der Entstehenung von Krankheiten oder Alterungsprozessen im Visier haben.
| Mehr auf biotechnologie.de |
News: Weltweites 1000-Epigenome-Konsortium formiert sich Dossier: Jubiläum – 10 Jahre Humangenom |
In den Verbünden sollen sich idealerweise Arbeitsgruppen aus grundlagennaher, kliinischer und industrieller Forschung zusammeschließen. Als Partner kommen daher nicht nur Universitäten und Großforschungseinrichtungen, sondern auch kleine und mittelständische Unternehmen in Frage - dies gilt insbesondere bei anwendungsnahen Fragestellungen. Ausführliche Informationen zu den Anforderungen gibt es beim Bundesforschungsministerium (zur Bekanntmachung: hier klicken) Die Bewerbungsfrist läuft noch bis zum 19. Mai 2011, die Unterlagen müssen beim Projektträger im DLR eingereicht werden.
Die Abwicklung der Fördermaßnahme und Betreuung der Antragsteller übernimmt der Projektträger im DLR: www.gesundheitsforschung-bmbf.de
Merck kooperiert mit Max-Planck-Gesellschaft bei Krebsforschung
Die Darmstädter Merck KGaA und die Lead Discovery Center GmbH in Dortmund, eine Ausgründung von Max-Planck Innovation, suchen künftig gemeinsam nach neuen Kinase-Inhibitoren zur Behandlung von Krebs.
Für die Suche werden die beiden Partner eine am Chemical Genomics Center der Max-Planck-Gesellschaft in Dortmund entwickelte neuartige Screeningplattform nutzen. Sie werden dabei vom Bundesministerium für Bildung und Forschung (BMBF) innerhalb der BioPharma-Initiative unterstützt, die sich zum Ziel gesetzt hat, die pharmazeutische Wertschöpfungskette in Deutschland zu stärken(mehr…).
| Mehr auf biotechnologie.de |
News: Schneller marktreif in Dortmund News: BioPharma-Wettbewerb - 100 Millionen Euro für drei Siegerkonsortien |
Die Forscher wollen mindestens eine Kinase identifizieren und soweit optimieren, dass das Enzym in der präklinischen Forschung weiter überprüft werden kann. Kinasen sind in der Lage, Phosphatreste auf andere Moleküle zu übertragen.
Damit spielen sie eine große Rolle bei der Regulation von Zellwachstum, Stoffwechsel und Differenzierung von Zellen. Gerade im Bereich der Krebsbehandlung konzentrieren sich deshalb viele Forschungsansätze darauf, diese Enzyme zu hemmen. Die Forscher hoffen, dass mit der neuen Screening-Plattform besonders starke Inhibitoren gefunden werden: „Mit Hilfe unserer patentgeschützten Technologie können wir Kinase-Inhibitoren identifizieren, die aller Voraussicht nach eine verbesserte Wirksamkeit und Selektivität zeigen werden," so Daniel Rauh, beteiligter Gruppenleiter am Chemical Genomics Center in Dortmund. Ob das identifizierte Molekül aber dann tatsächlich auch als Medikament taugt, ist ungewiss. Mit dem Abschluss der Leitstrukturoptimierung beginnen nämlich erst die präklinischen und klinischen Entwicklungsarbeiten. Nur einer von Dutzenden Kandidaten wird am Ende dieses Prozesses tatsächlich als Medizin zugelassen.
Vielseitige Immunzelle kann Entzündungen verstärken und dämpfen
Normalerweise verstärken Th17-Zellen Entzündungen, unter bestimmten Vorraussetzungen können Sie aber auch eine überschießende Immunantwort dämpfen, berichten Forscher aus Hannover.
Die Immunzellen vom Typ Th17 sorgen normalerweise dafür, dass keine Bakterien die Darmwand überwinden und so zu Krankheiten führen. Jedoch haben sie auch noch eine andere Rolle: „Th17-Zellen sind seit einiger Zeit im Gespräch, weil sie bei Rheuma, Arthritis und anderen immunentzündlichen Erkrankungen die Entzündung verstärken oder sogar auslösen", sagt Matthias Lochner, Nachwuchsgruppenleiter am Institut für Infektionsimmunologie der Twincore GmbH in Hannover.
| Mehr auf biotechnologie.de |
Wissenschaft: Chronobiologie - So tickt das Immunsystem Förderbeispiel: Verdächtiges Bakterium in der Kuhmilch erkennen |
Um solche Leiden zu behandeln, versuchen Medikamentenhersteller die Bildung von Th17-Zellen zu blockieren - und damit der Entzündung zumindest den Verstärker nehmen. "Also haben wir uns die Rolle der Th17-Zellen im Darm genauer angesehen. Denn auch dort kommt es zu immunentzündlichen Erkrankungen“, so Lochner. Ihre Ergebnisse haben die Wissenschaftler in der Fachzeitschrift "Journal of Experimental Medicine" veröffentlicht (2011, Band 208, S. 125-34). Um die Funktion von Th17-Zellen besser zu verstehen, haben die Forscher die Produktion dieser Zellen im Mäusedarm gestoppt. Mit erstaunlichem Ergebnis: Der Darm hat offenbar für diesen Fall offenbar einen Notfall-Plan. Er stellt auf eine Immunregulation um, bei der eine große Anzahl von Immun-Zell-Follikeln gebildet wird, die nun die Steuerung der Darmflora übernehmen. Wird dieses Notfallsystem jedoch gestört, entzündet sich der Darm viel heftiger als mit dem normalen Immunsystem. Erst wenn die Forscher die Th17-Zellen in den Darm bringen, beruhigt er sich wieder. Ein überraschender Rollgenwechsel, bremst Th17 doch plötzlich eine Entzündungsreaktion, die er bei anderen entzündlichen Erkrankungen verstärken würde. Damit ist die Blockade von Th17-Zellen womöglich keine geeignete Therapie bei Autoimmunerkrankungen, so Lochner: „Offenbar erfüllt Th17 auch wichtige regulatorische Aufgaben und wir wissen nicht, was eine generelle Blockade etwa bei Rheuma oder Arthritis für Auswirkungen haben kann."
iPS-Zellen: Neue Abkürzung von der Haut- zur Nervenzelle
Von der Hautzelle zur Herzzelle in nur 11 Tagen - amerikanische Wissenschaftler haben nun eine Abkürzung zur Reprogrammierung von ausdifferenzierten Zellen gefunden.
Seit 2007 ist es möglich, Hautzellen des Menschen in sogenannte induzierte pluripotente Stammzellen (iPS-Zellen) umzuwandeln, die Uhr der Zellentwicklung also fast bis zum Anfang zurückzudrehen. Das Verfahren wurde laufend verbessert, mittlerweile reichen RNA-Fragmente zur Reprogrammierung aus (mehr...). Ziel ist es, die iPS-Zellen in der regenerativen Medizin als Zellersatz in beschädigten Organen einzusetzen.
| Mehr auf biotechnologie.de |
Wochenrückblick: Hautzellen direkt zu Nervenzellen umgewandelt |
Amerikanische Forscher haben nun eine Abkürzung auf dem Weg zur Herzzelle entdeckt und berichten darüber im Fachjournal Nature Cell Biology (Online-Veröffentlichung, 30. Januar 2011). „In elf Tagen gelangten wir von Hautzellen in einer Kulturschale zu schlagenden Herzzellen“, sagt Studienleiter Sheng Ding vom Scripps Research Institute in La Jolla, Kalifornien. Anstatt erst iPS-Zellen zu erzeugen und daraus dann die gewünschten Körperzellen zu züchten, schalteten die Forscher die vier zur Reprogrammierung benutzten Gene bereits nach vier Tagen ab, lange bevor die Zellen sich in einen Embryonalzustand verwandelt hatten. Dann gaben die Forscher den Zellen ein Signal, sich in Herzzellen zu verwandeln.
Ding vergleicht die Entdeckung mit der Erforschung des Weltraums. Bislang gelte die Ansicht, man müsse auf dem Mond zwischenlanden, um zu anderen Planeten zu fliegen. Doch jetzt könne die Rakete direkt zu den Planeten gelenkt werden. „Das ist ein total neues Paradigma.“ Vom Prinzip her ist es nicht ganz so neu. Forscher um Marius Wernig von der kalifornischen Stanford University konnten im Januar 2010 Hautzellen direkt zu Nervenzellen umwandeln (mehr...). Nun ist auch für Herzzellen ein direkter Weg gefunden.
Doch obschon die neue Methode Probleme umgeht, die bei der vollständigen Reprogrammierung von Hautzellen auftauchen, gibt es auch hier Hindernisse. Derzeit versuchen Ding und seine Kollegen, die vier Gene, die mit der Entstehung von Krebs in Zusammenhang gebracht werden, durch anderen Stimulanzien zu ersetzen. Dann könnte auch das Fernziel wieder etwas näher rücken, körpereigenes beschädigtes Gewebe bei Patienten einfach nachzuzüchten.
Schaltzentrale in der Leber sorgt für höheren Blutdruck
Blutdruck und Stoffwechsel werden nicht nur im Gehirn reguliert, sondern zum Beispiel auch von der Leber aus. Nach jahrelanger Suche haben Forscher aus Berlin und Hannover jetzt eine neue Gruppe von Sensoren ausgemacht.
Vor mehr als zehn Jahren konnte Jens Jordan, damals noch an der Vanderbilt University im US-amerikanischen Nashville, etwas Ungewöhnliches beobachten: Bei Patienten mit geschädigtem Nervensystem erhöhte sich der Blutdruck um bis zu 50 mmHg, wenn diese in einem Zug einen halben Liter Wasser tranken.
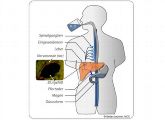

Der gleiche Effekt trat auch bei jungen Menschen ein, deren vegetatives Nervensystem durch Medikamente stimuliert wurde, sowie bei gesunden älteren Menschen. Zusammen mit seinem Kollegen Friedrich Luft vom Charité-Zentrum für experimentelle und klinische Forschung in Berlin rekrutierte Luft, der mittlerweile an der Medizinischen Hochschule in Hannover forscht, noch Stefan Lechner und Gary Lewin vom Max-Delbrück-Centrum für Molekulare Medizin (MDC) in Berlin und startete ein Forschungsprojekt. Jetzt sind die Molekularmediziner in der Leber fündig geworden.
Die Forscher beobachteten bei gentechnisch veränderten Mäusen, dass bestimmte Nervenzellen in der Leber aktiv auf Wasserzufuhr reagieren. Durch die plötzliche Wasserzufuhr sinkt die Osmolalität in den Blutgefäßen der Leber unter ihren Sollwert. Diese Abweichung wird von Sensoren in der Leber, den Osmorezeptoren, registriert, wie die Forscher jetzt nachweisen konnten. Sie stellten fest, dass diese Rezeptoren die Information in ein elektrisches Signal umwandeln, das dann wiederum einen Reflex auslöst und die Leberblutgefäße anregt, den Blutdruck zu erhöhen.
Um die Rolle und die Funktion des TRPV4 in diesem Regulationsprozess aufzuklären, benutzten die Forscher in ihren Experimenten Mäuse, in denen das Gen für den für das Nervensignal wichtigen Ionenkanal TRPV4 ausgeschaltet wurde. Nachdem sie diesen Knock-out-Mäusen Wasser zu trinken gegeben hatten, konnten sie keine Aktivierung der Osmorezeptoren in der Leber beobachten. Schon jetzt zeigen sich erste Ergebnisse der Entdeckung im Klinikalltag. "Wir lassen Patienten, die aufgrund von Störungen der Blutdruckregulation im Stehen Ohnmachtsanfälle erleiden, gezielt Wasser trinken", sagt Jordan. Langfristig könnten die neuen Sensoren auch zu neuen therapeutischen Ansätzen für die Behandlung von Erkrankungen führen, deren Ursache das fehlende Gen für das TRPV4-Kanalprotein ist.
