Wochenrückblick KW 10
Wie der Embryo Wurzeln schlägt
Tübinger Genetiker haben wichtige Entwicklungsschritte aufgeklärt, die im jungen Pflanzenembryo die Bildung der ersten Wurzel einleiten.
Wie die Entwicklungsgenetiker um Gerd Jürgens im Fachjournal Nature (10. März 2010, Online-Vorabveröffentlichung) berichten, haben sie das genetische Netzwerk für die Musterbildung in einer sehr frühen Phase des Lebens der Modellpflanze Ackerschmalwand (Arabidopsis thaliana) untersucht. Sie konnten zeigen, wie die Pflanze ihre erste Wurzel bildet: Bereits im winzigen Zellhaufen im Samen aktiviert eine Kombination aus einem Pflanzenhormon, einem Steuerungsfaktor und zwei weiteren Proteinen die Wurzelgründungszelle. Diese Erkenntnisse könnten in Zukunft dazu beitragen, Pflanzen zu züchten, die ein besonders leistungsfähiges Wurzelsystem aufweisen.
Am Anfang der Pflanzenentwicklung steht die befruchtete Eizelle. Aus ihr entwickelt sich nach vielen Zellteilungen ein komplexer Organismus mit verschiedenen Organen und Geweben. Erstaunlich und immer noch weitgehend ungeklärt ist dabei, woher die Zellen „wissen“, zu welchen Organen sie sich später entwickeln sollen. Die Wissenschaftler vom Zentrum für Molekularbiologie der Pflanzen (ZMBP) der Universität Tübingen und der niederländischen Universität Wageningen haben zusammen mit Kollegen vom Max-Planck-Institut für Entwicklungsbiologie erforscht, wie dieser Prozess gesteuert wird.
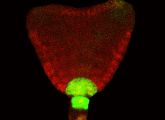
Im Samen der Ackerschmalwand bildet sich der Embryo aus der befruchten Eizelle, die sich zunächst in zwei Tochterzellen teilt. Eine der beiden Zellen bildet später fast den gesamten Embryo, während die andere ein Verbindungsgewebe hervorbringt, das den Embryo im Nährgewebe verankert. Ist der Embryo zu einem kleinen Zellknäuel herangewachsen, wird die an den Embryo angrenzende Zelle des Verbindungsgewebes durch Signale dazu angeregt, das Wurzelgewebe zu gründen.
| Mehr zum Thema auf biotechnologie.de |
News: Ein dichteres Wurzelnetz gegen Trockenheit News: Enormes Tempo der Evolution überrascht Pflanzenforscher |
Die Forscher konnten nun etliche der Mitspieler in dem komplizierten Regulierungsgeflecht identifizieren: Die Ausbildung des Wurzelgewebes hängt zum einen von der Anhäufung des Pflanzenhormons Auxin ab, das vom Embryo zur Wurzelgründungszelle gelenkt wird. Verstärkt wird dieser Vorgang durch den Transkriptionsfaktor namens Monopteros.Doch das allein reicht nicht aus. Die Forscher folgerten, dass Monopteros gezielt weitere Gene aktivieren muss. Bei einer umfassenden Erhebung aller von Monopteros angeschalteten Erbgutabschnitte fanden sie zwei Gene, die bereits während der Embryonalentwicklung eine Rolle spielen: TMO5 und TMO7. Beide sind notwendig, damit sich das Wurzelgewebe ausbilden kann. Das vom TMO7-Gen gebildete Protein muss dazu vom Ort seines Entstehens im Embryo in die Wurzelgründungszelle wandern. „Mit TM07 haben wir ein bislang unbekanntes interzelluläres Signal für die Wurzelbildung im Embryo gefunden“, sagt Gerd Jürgens.
Micromet holt sich 70 Millionen US-Dollar am Kapitalmarkt
Wie schon 2009 hat sich der deutsch-amerikanische Antikörperentwickler Micromet 70 Mio. US-Dollar am Kapitalmarkt besorgt.
2009 mussten dafür wegen eines schlechteren Kurses noch 14 Millionen frische Aktien verkauft werden (mehr...), diesmal reichten 10 Millionen zum Stückpreis von 7 US-$ aus. Illustre Namen stehen hinter der Anschlussfinanzierung: Unterschrieben haben Goldman Sachs, Piper Jaffray, RBC Capital Markets, Needham, Roth Capital Partners, Ladenburg Thalmann und die Maxim Group.
Micromet hatte offenbar keine Probleme, Geldgeber zu finden. Am 9. März ging die Ankündigung erst raus, am 11. März war das Volumen schon ausgeschöpft. Der Grund für die große Attraktivität von Micromet sind die hauseigenen Bite-Antikörper. Den modifizierten Antikörpern wird von vielen Beobachtern eine große Zukunft vorhergesagt. Im vergangenen Jahr hat sich der Kurs des an der amerikanischen Technologiebörse Nasdaq gelisteten Unternehmens deshalb in etwa verdreifacht.
| Mehr zum Thema auf biotechnologie.de |
Wochenrückblick: Micromet sichert sich Finanzierung von 58 Millionen Euro |
Mit dem Kapital wird Micromet unter anderem die Entwicklung des Leitprodukts MT103 vorantreiben. Blinatumomab soll gegen eine spezielle Form der Leukämie (ALL) sowie Non-Hodgkin-Lymphome eingesetzt werden. Mitte 2010 sollen die ersten Patienten für zulassungsrelevante Tests für den Einsatz gegen ALL rekrutiert werden, sagte CEO Christian Itin gegenüber Investoren am 10. Februar 2010. MT103 zielt auf das CD19-Antigen und dient als Schalter zwischen der Tumorzelle und T-Zellen.
Deren Aktivierung führt dazu, dass sich das patienteneigene Immunsystem gegen die malignen Zellen richtet und diese vernichtet. Im Gegensatz zu herkömmlichen Antikörpern – den passiven Immuntherapien – löst der sogenannte Bite-Antikörper eine aktive Reaktion des Immunsystems aus, die den neuen Therapieansatz attraktiv macht. Die Micromet Inc. ist ein im Kern deutsches Biotech-Unternehmen, das sämtliche Forschungsaktivitäten vom Standort München ausführt. Über eine Fusion mit der börsennotierten CancerVax Inc. und eine anschließende Umbenennung gelangten die Münchener Anfang 2006 an die Nasdaq und verlegten den juristischen Sitz der Firma in die USA.
Eigene Immunzellen verstärken Schlaganfall-Risiko
Mäuse ohne T-Zellen als Bestandteile des Immunsystems erleiden harmlosere Hirnschläge als normale Artgenossen.
Für die Abwehr von Krankheitserregern sind beim Menschen unter anderem die T-Zellen zuständig, die in den Blutbahnen patrouillieren. Deutsche Forscher haben nun bei Versuchen mit Mäusen einen gefährlichen Nebeneffekt der Körperpolizei festgestellt: Je mehr Immunzellen im Blut sind, desto kritischer verlaufen Schlaganfälle. Die Forscher von der Neurologischen Universitätsklinik und vom Rudolf-Virchow-Zentrum für experimentelle Biomedizin in Würzburg berichten im Fachjournal Blood (9. März 2010, Online-Vorabveröffentlichung).
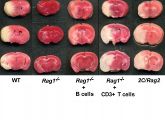

Alle zwei Minuten erleidet in Deutschland ein Mensch einen Schlaganfall. Die Ursache ist meistens eine Verstopfung der Blutgefäße, die das Gehirn versorgen. Wer einen Schlaganfall überlebt, kann schwere Behinderungen wie Sprachstörungen oder Lähmungen davontragen. Verstopft werden die Blutgefäße in der Regel von verklumptem Blut, weshalb die Suche nach besseren Therapien auch bei der Blutgerinnung ansetzt, die zur Bildung der gefährlichen Pfropfen führt. Umso erstaunter waren nun Würzburger Wissenschaftler, als sie an anderer Stelle fündig wurden: Auch die T-Zellen des Immunsystems spielen beim Schlaganfall eine Rolle.
Die Würzburger Arbeitsgruppe um Christoph Kleinschnitz hat festgestellt, dass Mäuse, denen wegen eines genetischen Defekts T-Zellen fehlen, kleinere Schlaganfälle als normale Artgenossen erleiden. Außerdem entwickelten sie nach dem Schlaganfall weniger neurologische Ausfallerscheinungen wie etwa Lähmungen. Fazit: T-Zellen haben einen negativen Effekt auf den Verlauf von Schlaganfällen.
| Mehr zum Thema auf biotechnologie.de |
News: Impfen gegen Diabetes - Selbstzerstörerische Immunzellen bei Mäusen in den Griff bekommen Menschen: Veit Hornung - Wie Feinde vom Immunsystem erkannt werden |
"Dass T-Zellen bei akuten Schlaganfällen eine derart schädigende Wirkung ausüben, kam für uns völlig überraschend", berichtet Kleinschnitz. Die schädliche Wirkung geht offenbar besonders auf zwei Untergruppen zurück, die sogenannten CD4- und CD8-positiven Helferzellen.
Unklar ist noch, wie die T-Zellen einen Schlaganfall verstärken. Zwei mögliche Mechanismen haben die Würzburger Wissenschaftler in ihren Experimenten ausgeschlossen. Erstens fördern die T-Zellen nicht die Verklumpung der Blutplättchen untereinander, und zweitens befeuern sie die Blutpfropfen-Bildung auch nicht durch eine Immunreaktion.
Die Forscher hoffen, dass ihre weiteren Arbeiten die Schlaganfall-Therapie beim Menschen verbessern helfen. Falls die Befunde auf den Menschen übertragbar sind, könnten sich neue Ansätze durch eine gezielte Beeinflussung der T-Zellen ergeben. Denkbar ist es zum Beispiel, in der Frühphase eines Schlaganfalls die schädliche Fraktion der T-Zellen vorübergehend auszuschalten und so die Ausfallerscheinungen zu lindern.
Forscher diskutieren in München über Metabolomics
Bei einem dreitägigen Symposium in München haben 400 Teilnehmer diskutiert, wie die Forschungsdisziplin „Metabolomics“ die Lebenwissenschaften künftig verändern wird.
Metabolomics ist ein Forschungszweig der Systembiologie, der sich mit der Erforschung von Stoffwechselprodukten und charakteristischen Stoffwechseleigenschaften beschäftigt. Als Querschnittstechnologien kommen Metabolomics-Methoden in allen Teilbereichen der Lebenswissenschaften zum Einsatz.
Unter dem Titel "Metabolomics & More - The Impact of Metabolomics on the Life Sciences" gingen vom 10. bis 12. März erörterten die Teilnehmer aus Forschung und Industrie, wie die neue Methoden die medizinische Diagnostik und Therapieentwicklung, die Ernährungs- und Lebensmittelwissenschaften und die Analytik in den Lebenswissenschaften beeinflussen. Ein spezielles Augenmerk galt den Bemühungen zu Standardisierungen bei der Durchführung von Metabolomics-Studien und die Vorstellung nationaler Metabolomics-Initiativen in anderen Ländern.
Veranstaltet wurde das Symposium in München von der Munich Functional Metabolomics Initiative, ein Forschungsverbund von Technischer Universität München, Helmholtz Zentrum München und Industriepartnern. Thomas Hofmann, Vizepräsident der Technischen Universität München und Inhaber des Lehrstuhls für Lebensmittelchemie und Molekulare Sensorik, sagte: "Im Bereich der Lebensmittel- und Ernährungsforschung muss es uns gelingen, die Auswirkungen funktioneller Lebensmittelinhaltsstoffe auf das menschliche Stoffwechselgeschehen quantitativ zu erfassen.
| Mehr zum Thema auf biotechnologie.de |
News: Dem Kaffee im Stoffwechsel auf der Spur News: Wie Biomarker das biologische Alter verraten Menschen: Hannelore Daniel- Energische Gestalterin der Ernährungsforschung |
Mit moderner Analytik werden wir in die Lage versetzt, mit hoher Auflösung die Dynamik unseres Stoffwechsels und die interindividuellen Unterschiede als einzigartigen Fingerabdruck des Menschen zu charakterisieren.“
Der Wissenschaftlich-Technische Geschäftsführer des Helmholtz Zentrums München, Günther Wess, betonte die Bedeutung metabolomischer Verfahren für Diagnostik und Therapieentwicklung von Stoffwechselerkrankungen. "Die Zukunft liegt in maßgeschneiderten Therapien und passgenau einsetzbaren Molekülen für definierte Patientengruppen. Das wird nicht nur die Wirksamkeit, sondern auch die Sicherheit von Medikamenten erhöhen. Wir können das aber nur leisten, wenn wir zu den wichtigen häufigen Krankheiten endlich die Ursachen aufklären und die Erkenntnisse schnell zur Anwendung bringen. Für die Medizin von Morgen müssen wir die Brücke zwischen Grundlagenforschung und Klinik bauen, indem wir die führenden Forschungspartner zusammen bringen und vernetzen", so Wess in München.
Mehr Informationen zur Veranstaltung: hier klicken
Atomare Struktur eines Nervtöters aufgeklärt
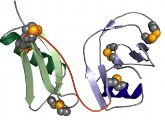
Die molekulare Architektur des vermeintlichen Übeltäters bei der Alzheimer-Erkrankung ist teilweise aufgeklärt: Strukturbiologen aus Jena haben einen wesentlichen Teil der dreidimensionalen Struktur des Amyloid-Vorläuferproteins (APP) entschlüsselt.
Die Wissenschaftler vom Leibniz-Institut für Altersforschung - Fritz-Lipmann-Institut in Jena berichten im Fachblatt PNAS (9. März 2010, Online-Vorabveröffentlichung) über ihre Strukturanalysen. Mittels Proteinkristallographie haben die Forscher um Manuel Than den atomaren Aufbau und die räumliche Molekülstruktur der E1-Domäne von APP sichtbar gemacht.
Die Ergebnisse zeigen: Zwar können Spaltprodukte dieses Proteins das Hirnleiden Alzheimer auslösen, APP erfüllt aber auch wichtige biologische Funktionen.Die Alzheimer-Erkrankung wird durch unlösliche Eiweißbestandteile ausgelöst, die sich in der Umgebung von Nervenzellen ablagern. Diese Proteinklumpen - auch Beta-Amyloide genannt - schädigen die Nervenzellen, bis diese schließlich absterben. Mittlerweile ist bekannt, dass diese neurotoxischen Eiweißablagerungen aus Spaltprodukten eines bestimmten Makromoleküls bestehen, das auf der Membran von Nervenzellen zu finden ist: APP. Bisher lagen die natürlichen Funktionen von APP weitgehend im Dunkeln. Es wird vermutet, dass APP eine Rolle beim Kontakt zwischen Zellen spielt, aber auch bei der Kommunikation der Zelle mit ihrer Umgebung. Auch als Wachstumsfaktor sowie bei der Übertragung von Signalen in der Zelle scheint APP in Erscheinung zu treten. Die Jenaer Forscher haben nun herausgefunden, dass sich das gesamte Protein zu einem Doppelmolekül zusammenlagert, wenn der pharmakologische Wirkstoff Heparin zugegeben wird. Heparin-ähnliche Substanzen kommen im Körper als sogenannte Heparansulfate häufig vor. Als Bestandteil der extrazellulären Matrix sind sie also vor allem außerhalb der Zellen anzutreffen.
| Mehr zum Thema auf biotechnologie.de |
News: Eiweiße in drei Dimensionen sehen und drehen Menschen: Paola Fucini-Strukturbiologischer Blick auf molekulare Arbeitstiere |
Solche Doppelmoleküle, auch Dimere genannt, findet man häufig bei Rezeptoren, die bei der Signalübertragung mitwirken. Außerdem werden sie als verbindende Elemente bei der Zusammenlagerung von unterschiedlichen Zellen beobachtet. Die Jenaer Forscher sehen in der Heparin-abhängigen Zusammenlagerung einen strukturellen Hinweis auf die Rolle von APP bei der Signalübertragung oder der Zellanhaftung.
Das Heparin-vermittelte Doppelmoleküle konnten die Forscher auch biochemisch nachweisen. Die Wissenschaftler vermuten, dass das Amyloid-Vorläufer-Protein an unterschiedlichen Stellen in der Zelle verschiedene Formen annimmt und somit jeweils andere Funktionen erfüllen kann. Entscheidend für die jeweilige Struktur und Funktion sind womöglich die jeweiligen Zellbereiche und Organellen, in denen das APP seine Wirkung entfaltet. "In Zukunft wird sich die Forschung daher darauf konzentrieren, die zellort- und organspezifischen Formen und Funktionen von APP aufzuklären", sagt Than. Doch eines ist jetzt schon klar: APP ist weitaus mehr als nur ein neurotoxischer "bad guy".
Gen-Scheren mit Licht an- und abschalten
Molekularbiologen der Universität Gießen haben DNA-spaltende Enzyme so verändert, dass sie sich durch Licht kontrollieren lassen.
Damit haben sie ein wichtiges Werkzeug für die Gentherapie beim Menschen entwickelt. Die Gießener Forscher um Benno Schierling berichten im Fachblatt Proceedings of the National Academy of Sciences (2010, Bd.107, S.1361-1366). Die Forscher bauten einen chemischer Schalter so in eine Gen-Schere ein, dass sich deren Aktivität durch langwelliges ultraviolettes Licht anstellen und durch blaues Licht abstellen ließ.
| Mehr zum Thema auf biotechnologie.de |
News: Nervenkrankheit ALD erstmals mit Gentherapie geheilt Menschen: Alexander Heckel: Licht an – Gen aus |
Damit sei der prinzipielle Nachweis geglückt, dass die Aktivität der Gen-Scheren durch Licht zeitlich und räumlich kontrollierbar sei, so der Erstautor Benno Schierling von der Justus-Liebig-Universität Gießen (JLU). Dies sei eine wesentliche Voraussetzung dafür, dass solche Enzyme in der Gentherapie beim Menschen genutzt werden können.Der Austausch von defekten durch intakte Gene wurde im Zellkulturmodell schon erfolgreich durchgeführt. Dabei entdeckten Forscher allerdings, dass eine Rest-Toxizität auftreten kann, die für eine Therapie beim Menschen nicht akzeptabel wäre. Diese Toxizität wird darauf zurückgeführt, dass die maßgeschneiderten Gen- Scheren bei langer Einwirkzeit auch an unspezifischen Stellen die DNA spalten und damit neue Gendefekte auslösen. Dies ließe sich verhindern, wenn man diese Enzyme so verändert, dass sie an- und abschaltbar sind. Bei einer Gentherapie an Zellen, die dem Organismus entnommen und nach der erfolgten Therapie wieder zurückgegeben werden, könnten abschaltbare Gen-Scheren das Problem der Rest-Toxizität lösen.