Gentherapie für die Netzhaut: Es werde Licht
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
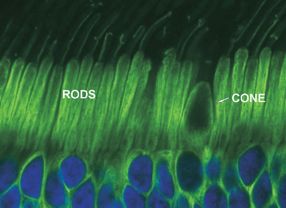
- Auf der Netzhaut befinden sich zwei Rezeptortypen: Stäbchen (Rod) und Zapfen(Cone). Deutsche Forscher konnten mittels Gentherapie die Funktionsfähigkeit von defekten Zapfen wiederherstellen. Quelle: British Retinitis Pigmentosa Society
23.07.2010 -
Das Sehvermögen ist der wichtigste Sinn des Menschen. Hochspezialisierte Photorezeptorzellen sorgen dafür, dass wir sowohl tagsüber als auch nachts optimal sehen können. Genetische Defekte allerdings beeinträchtigen die Funktion der Rezeptorzellen empfindlich. Bei der Achromatopsie sind die sogenannten Zapfen der Netzhaut geschädigt. Die Folge: Die Betroffenen können weder farbig noch scharf sehen. Forscher aus Tübingen und München konnten nun die Krankheit bei Mäusen behandeln, indem sie den gesunden Genabschnitt in die DNA der Rezeptorzellen einschleusten. Das könnte auch beim Menschen zu neuen Behandlungserfolgen führen, konstatieren die Forscher im Fachblatt Molecular Therapy (Online-Veröffentlichung, 13. Juli 2010). Wissenschaftler aus Basel nutzten wiederum die genetisch modifizierten Mäuse der deutschen Kollegen, um eine besonders häufige genetisch bedingte Augenkrankheit rückgängig zu machen: die Retinitis Pigmentosa. Die Schweizer berichten im Journal Science (Online-Veröffentlichung, 24. Juni 2010).
Auf der Netzhaut des Auges kommen zwei unterschiedliche Arten von Rezeptorzellen zum Einsatz. Während die besonders lichtempfindlichen Stäbchen-Zellen nachts dafür sorgen, dass auch bei niedriger Lichtintensität Formen erkannt werden können, sind die Zapfen tagsüber im Einsatz. Sie sind dafür verantwortlich dafür, dass wir Farben unterscheiden und scharf sehen können.
Achromatospie-Betroffene können nur Graustufen sehen
Die Zapfen sind komplex. Mehr als 200 Gene werden benötigt, damit sie einwandfrei funktionieren. Das macht sie anfällig für genetische Defekte. Eine einzige Mutation kann erhebliche Sehstörungen verursachen und bis hin zur Blindheit führen. Ein Beispiel für eine genetisch bedingte Sehschwäche ist die Achromatopsie. Aufgrund eines Gendefekts bildet die Netzhaut bei Menschen mit dieser seltenen Krankheit keine funktionsfähigen Zapfen aus. Die Betroffenen können daher nur Graustufen unterscheiden, sehen unscharf, sind überempfindlich gegenüber hellem Licht und leiden unter Augenzittern. Im Laufe ihres Lebens kommt es zudem zu einer fortschreitenden Degeneration der Netzhaut, die schließlich zur völligen Erblindung führt.
Zwei Forscherteams um den Pharmakologen Martin Biel von der Ludwig-Maximilians-Universität München und Mathias Seeliger vom Universitätsklinikum Tübingen ist es nun erstmals gelungen, Achromatopsie zumindest bei Mäusen zu heilen. „Noch können wir nicht beurteilen, ob entsprechende Behandlungsansätze langfristig auch beim Menschen erfolgreich sein werden“, sagt Biel. „Unsere Ergebnisse haben jedoch ohne Zweifel großes Potential für die Behandlung genetischer Formen der Blindheit beim Menschen.“ Ebenfalls beteiligt war die Arbeitsgruppe von Dr. Tim Gollisch, Max-Planck-Institut für Neurobiologie in Martinsried bei München.
Mit Hilfe von Viren das richtige Gen einschleusen
Die Krankheit wird in der überwiegenden Mehrheit der Fälle durch Mutationen entweder im CNGA3-Gen oder im CNGB3-Gen ausgelöst. In beiden Fällen führen die genetischen Veränderungen dazu, dass ein Ionenkanal in den Zapfen nicht mehr richtig gebildet wird. Dieser wiederum ist wichtig, damit die Zapfen einwandfrei arbeiten können.
Die beiden Wissenschaftlergruppen aus Tübingen und München stellten die Krankheit nun in Mäusen nach, indem sie das CNGA3-Gen auf biotechnologischem Weg stilllegten. „In unserem Tiermodell fehlte der Ionenkanal CNGA3“, berichtet Biel. Die Mäuse litten damit an den gleichen Symptomen wie Achromatopsie-Patienten. Um den Gendefekt wieder zu beheben, nahmen die Wissenschaftler Viren zu Hilfe. Diese sind von Natur aus in der Lage, ihr eigenes Erbgut in andere Zellen einzuschleusen und diese für ihre Zwecke damit umzuprogrammieren. An der LMU veränderten die Forscher die Viren nun so, dass diese nicht mehr ihr eigenen Erbgut, sondern eine korrekte Kopie des CNGA3-Gens in die Zellen transportierten. Die Experimente der Forscher zeigten dann: Nachdem der DNA-Abschnitt im Zellkern eingebaut worden war, konnte die Zapfen-Zelle wieder den so wichtigen Ionenkanal ausbilden. Die Mäuse konnten wieder sehen. In funktionellen Studien konnten die Forscher zudem zeigen, dass die Lichtrezeptoren der Tiere durch diese Gentherapie wieder auf Lichtreize reagieren und diese Information an nachgeschaltete Zellen des Sehsystems weitergeben.
| Mehr auf biotechnologie.de |
Förderbeispiel: Alzheimer per Laserscan der Netzhaut erkennen News: Epigenetische Unterschiede - Nachtschwärmer sehen anders |
„Diese Photorezeptoren waren von Geburt an funktionslos“, sagt Biel. „Es hat uns sehr gefreut, dass sie dank unserer Therapie zum ersten Mal normal auf Licht reagierten und damit den Tieren das Sehen ermöglichten.“ Aus medizinischer Sicht ist ein zweiter Effekt des Experiments ebenso erfreulich: Das für die Krankheit charakteristische Absterben der Zapfen und die Degeneration der Netzhaut wurden deutlich verlangsamt. "Dieser Aspekt ist für uns natürlich von besonderer Bedeutung", ergänzt Seeliger. "Unsere Ergebnisse lassen hoffen, dass derartige Gentherapieansätze in Zukunft eine Möglichkeit zur Vorbeugung und Behandlung genetischer Blindheit darstellen." Allerdings ist bis dahin noch einiges an Grundlagenforschung zu leisten.
Mausmodell auch bei anderen Augenkrankheiten im Einsatz
Zunächst einmal wird die Forschung sich auf Tiere beschränken. Mit ihren genetisch veränderten Mäusen haben die Wissenschaftler nun ein Modellsystem geschaffen, das auch bei der Erforschung anderer genetischer Augenkrankheiten gute Dienste leisten könnte. Das zeigte das Team um Botond Roska vom Friedrich-Mischer-Institut in Basel. Die Münchener veränderten Mäuse zunächst so, dass sie die Symptome der häufigsten genetisch verursachten Augenkrankheit zeigten, der Retinitis Pigmentosa. Die Mäuse können ein bestimmtes Eiweiß nicht mehr bilden, dass das Bindeglied zwischen dem Lichtreiz und der Rezeptorzelle darstellt. Die Basler Forscher importierten mittels eines Virus nun das Gen für Halorhodopsin, ein Eiweiß aus einem Bakterium, in die Zapfenzelle der Mäuse.
Halorhodopsin ist in den Mikroben dafür zuständig Lichtreize umzuwandeln. Diese Aufgabe erfüllte es offenbar auch in den Mäusen. Tatsächlich gelang es den Basler Wissenschaftlern, die Lichtempfindlichkeit der Zapfen so wiederherzustellen. Auf diesen Ergebnissen aufbauend wollen die Forscher nun eine virale Gentherapie für Retinitis pigmentosa entwickeln. Ein erster Schritt in Richtung Mensch ist schon getan. In einem Experiment wurden defekte menschliche Zapfen-Zellen mit dem Halorhodopsin-Gen dazu gebracht, auf Lichtreize zu reagieren. Dennoch bleiben die Wissenschaftler vorsichtig. „Im Moment ist es noch zu früh, um zu beurteilen, wie wirksam solche Behandlungsansätze beim Menschen sein können", sagt Biel. "Unsere Ergebnisse lassen aber auf neue Optionen zur Vorbeugung und Behandlung genetisch bedingter Blindheit hoffen.“
Ein oder zwei Haken hätte die Verwendung von Halorhodopsin für die menschlichen Patienten allerdings. Zum einen kann das Bakterieneiweiß nur Schwarz-Weiß-Reize weiterleiten. Zum anderen ist es nichts so flexibel, wenn es um verschiedenen Helligkeiten geht. Hier müssten technische Vorrichtungen wie eine elektronisch gesteuerte Brille vorgeschaltet werden, um die Lichtintensität immer auf optimalem Niveau zu halten. An einem derartigen Gerät wird schon gearbeitet.