Enzyme biegen sich ihr Substrat zurecht
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
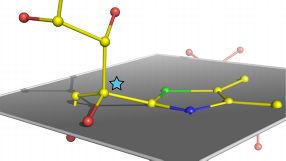
- Atomare Struktur eines verbogenen, kurz vor der Spaltung stehenden Zuckermoleküls. Eines der Kohlenstoffatome (Stern) ist aus der eigentlich zu erwartenden Position innerhalb der grau definierten Ebene mehr herausgebogen. Quelle: Universität Göttingen
29.08.2013 -
Von der Zerkleinerung der Nahrung bis zur Kopie der Erbsubstanz – Enzyme sind die Triebfeder der meisten biochemischen Reaktionen in Organismen. Wie sie dabei vorgehen, dazu existierten bisher nur Vermutungen: In ihren Aktiven Zentren verbiegen die Enzyme ihre Ausgangsstoffe, wie etwa Zuckermoleküle, um diese anschließend aufzubrechen. Diese Hypothese haben Göttinger Forscher nun experimentell bestätigt. Wie sie im Fachjournal Nature Chemistry (2013, Online-Veröffentlichung) berichten, ist es ihnen gelungen, die räumliche Struktur eines Zuckermoleküls in dem Moment abzubilden, in dem es von einem Enzym verbogen und anschließend gespalten wird.
Um die Arbeitsweise von Enzymen zu beschreiben, wird gerne das Bild von Schlüssel (Substrat) und Schloss (aktives Zentrum) gewählt. Doch ganz so mühelos passen die Reaktionspartner nicht immer zusammen. Bisher sind Biochemiker deshalb davon ausgegangen, dass Enzyme bei der Spaltung ihres Substrats dieses regelrecht verbiegen und danach auseinandernehmen. Das Wissenschaftlerteam um die Biochemiker Kai Tittmann und Ralf Ficner vom Göttinger Zentrum für Molekulare Biowissenschaften (GZMB) hat diese physikalisch verformten Strukturen beim Enzyms Transketolase nun auf molekularer Ebene sichtbar gemacht.
| Mehr zum Thema auf biotechnologie.de |
News: Wasserstoff von halbsynthetischen Enzymen News: Proteom-Analytik auf dem Weg in die Klinik Menschen: Thorsten Eggert: Der Enzym-Optimierer |
Highspeed-Momentaufnahmen
Das Enzym namens Transketolase kommt in Bakterien, Pflanzen und Tieren vor und spielt eine wichtige Rolle im Zuckerstoffwechsel. Für ihren Versuch züchteten die Strukturbiologen zunächst Proteinkristalle des Enzyms. Anschließend versetzten sie diese mit dem natürlichen Substrat des Enzyms, der Xylulose. Dabei handelt es sich um ein Zuckermolekül, das als Zwischenprodukt im Kohlenhydratabbau vorkommt. Die Verbindung des Enzymkristalls und seines Substrats analysierten die Forscher in Teilchenbeschleunigern in Berlin und im französischen Grenoble. Unmittelbar vor der Spaltung gelang es den GZMB-Forschern die ultrahochaufgelöste Struktur des Zuckermoleküls zu bestimmen. In Teilchenbeschleunigern können Elementarteilchen, Atome oder ganze Moleküle auf extreme Geschwindigkeiten beschleunigt werden. Die Teilchen erzeugen dadurch Lichtblitze von extrem kurzer Dauer und hoher Intensität. Elementare Vorgänge, wie die Bewegung in Molekülen, lassen sich durch die Messung der Lichtblitze in Echtzeit abbilden. Enzyme steuern den überwiegenden Teil der biochemischen Reaktionen. Wie das genau funktioniert, erklärt Jan Wolkenhauer in der neuen Kreidezeit.Quelle: biotechnologie.tv
Wie ein Werkstück im Schraubstock
Die genaue Position der Atome in dem Moment der Aufnahme in Referenz zur Ausgangsposition verriet eine Biegung im Molekül. „Dieser in seiner Schärfe bis heute einmalige Schnappschuss eines arbeitenden Enzyms offenbart unzweifelhaft, dass das Zuckersubstrat im Enzym verbogen wird wie ein eingespanntes Werkstück in einem Schraubstock“, erklärt Kai Tittmann. Das Enzym biegt das Zuckermolekül, weil der anschließende und entscheidende Arbeitsschritt, nämlich die Spaltung, weniger Energie verbraucht, wie die Forscher in ihren Experimenten gemessen haben. Der ganze Stoffwechselprozess kann dann energetisch effizienter ablaufen.
Enzymfunktion auch bei Krebs relevant
Weil zahlreiche Medikamente an der Wirkung von Enzymen ansetzen, sind die neuen Erkenntnisse für die maßgeschneiderte Arzneientwicklung interessant. Es gibt bestimmte Formen der Transketolase, die nur bei Säugetieren vorkommen und in verschiedenen Gewebetypen aktiv sind. Dort spielt das Enzym eine Rolle bei verschiedenen neurodegenerativen Erkrankungen, wie Diabetes und einigen Krebsformen. In bösartigen, schnell wachsenden Tumoren nimmt es beispielsweise an der Energieversorgung der entarteten Zellen teil. „Auch die in der vorliegenden Studie untersuchte humane Transketolase übt eine Schlüsselfunktion im Stoffwechsel von Krebszellen aus“, so Tittmann. Nicht nur als Angriffspunkt für Medikamente, sondern auch in der Diagnostik werden die Strukturen von Enzymen und Proteinen immer entscheidender. Letztendlich sind es nämlich die Proteine, die zur Entstehung einer Krankheit führen oder deren Ausprägungen anzeigen. Mit neuen Methoden der Proteomik könnte bei Krebspatienten beispielsweise bald auf aufwendige Biopsien verzichtet werden, da krebstypische Proteine aus Körperflüssigkeiten für eine Diagnose schon genügen.
© biotechnologie.de/bs