Wochenrückblick KW 08
Rückblick auf Kalenderwoche 8
Für den Zeitraum vom 18. bis 25. Februar 2013 hat biotechnologie.de für Sie die wichtigsten Nachrichten aus der Biotech-Branche zusammengestellt.
Wartungstrupp für verschlissene Muskelzellen
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
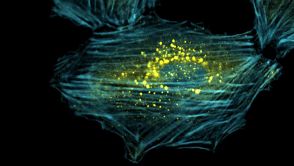
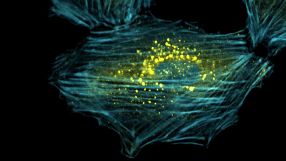
- Die sogenannten Autophagosomen (gelb), umschließen und verdauen beschädigte Bestandeteile des Zellulären Stutzsystems (blau). Quelle: Anna Ulbricht/Uni Bonn
Bonner Forscher haben aufgedeckt, wie das abgenutzte Stützgerüst von Muskelzellen entsorgt und umgehend wieder repariert wird.
Mit Hilfe bestimmter Eiweißmoleküle werden Verschleißteile des zellulären Stützgerüsts rechtzeitig ausgetauscht, bevor Schäden bedrohlich werden. Wie dies bewerkstelligt wird, haben nun Forscher unter Federführung der Universität Bonn herausgefunden. Sie berichten im Fachmagazin Current Biology (2013, Online-Vorabveröffentlichung). Muskelzellen, aber auch Blut-filtrierende Nierenzellen und Immunzellen, die im Zuge der Immunabwehr unseren Körper durchwandern, sind im Körper ständigem Verschleiß ausgesetzt. „Insbesondere das Protein Filamin wird dabei sehr beansprucht“, sagt Jörg Höhfeld vom Institut für Zellbiologie der Universität Bonn. Lebende Zellen verfügen zur Stabilisierung nicht über ein steifes Gerüst, sondern über elastische, fadenförmige Strukturen. Wirken Zugkräfte auf dieses „Skelett“ der Zelle, dann hält das Filamin als elastischer Kleber die Bestandteile zusammen. Molekulare „Anstandsdamen“ – sogenannte Chaperone – kontrollieren, ob die Proteine richtig gefaltet sind. Sie erkennen deshalb auch Schäden am Filamin und aktivieren seine Entsorgung in der Zelle. Eine wichtige Rolle beim Abbau spielt ein Chaperon-Helfer, der in Säugetieren „BAG3“ genannt wird. Er ist dafür verantwortlich, dass das „Bitte entsorgen!“-Etikett an das verschlissene Filamin geheftet wird.
| Mehr auf biotechnologie.de |
Dies führt zu einer Entsorgung des Verschleißteils in einem Vorgang der als Chaperon-assistierte selektive Autophagie (CASA) bezeichnet wird. Um diesen Entsorgungsvorgang besser zu verstehen, hat Höhfeld zusammen mit Forschern der Berliner Charité nach Kooperationspartnern von BAG3 gesucht. Dabei wurden nicht nur neue Bestandteile der Entsorgungsmaschinerie entdeckt, sondern auch die entscheidenden Komponenten, die für eine Neubildung des Filamins verantwortlich sind. „Diese Maschinerie sorgt dafür, dass sich der Abbau und der Aufbau des Zellklebers die Waage halten“, berichtet Höhfeld. Signal für diese Prozesse ist jeweils die mechanische Belastung des Zellskeletts. Damit haben die lebenden Zellen etwas erfunden, wovon jeder Autobesitzer träumt: Sobald ein wichtiges Verschleißteil kaputt geht, rückt automatisch der Wartungstrupp an und tauscht das schadhafte Teil aus. Dies funktioniert aber nicht, wenn die Erbanlage für BAG3 krankhaft verändert ist: Dann kommt es beim Menschen zu einer schwerwiegenden Muskelschwäche.
© biotechnologie.de/pg
Herzgewebe aus unbefruchteten Eizellen gezüchtet
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
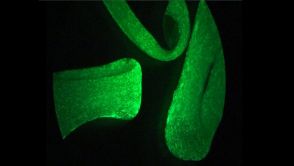
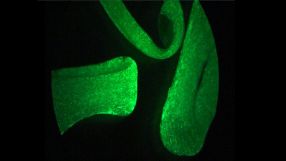
- Gezüchtetes Maus-Herzmuskelgewebe aus parthenogenetischen Herzmuskelzellen. Quelle: umg
Biomediziner aus Göttingen haben bei Mäusen erstmals im Labor zuckendes Herzgewebe aus Stammzellen von unbefruchteten Eizellen gezüchtet.
Damit könnten Schäden am Herzen nach Infarkten oder bei Herzmuskelschwächen repariert werden. Wie die Forscher im Journal für Clinical Investigation (2013, Online-Vorabveröffentlichung) berichten, haben sie im Labor nicht-embryonale Stammzellen aus einer bisher wenig beachteten Quelle gewonnen: aus unbefruchteten Eizellen. Dieser Weg wird auch Jungfernzeugung (Parthenogenese) genannt, die entstehenden Stammzellen heißen im Fachjargon parthenogenetische Stammzellen (PS-Zellen). Die Stammzellmediziner um Wolfram-Hubertus Zimmermann, Direktor der Abteilung Pharmakologie der Universitätsmedizin Göttingen, haben ausgehend von den PS-Zellen Herzgewebe gezüchtet, das ähnlich zuckt wie natürliches Herzgewebe und sich bei Mäusen therapeutisch zur Reparatur von Herzinfarkten einsetzen lässt. „Wichtig ist, dass bei diesem Verfahren keine Embryonen verwendet werden und keine genetischen Manipulationen notwendig sind.“ Zudem haben die Forscher herausgefunden, dass die PS-Zellen immunologisch einfacher „gestrickt“ sind als andere Stammzellen. Dies ist von großer Bedeutung für die breite Anwendung von gezüchtetem Herzmuskelgewebe für die Herzreparatur. „Mit künstlichem Herzgewebe aus parthenogenetischen Stammzellen kommt es zu keinen oder besser kontrollierbaren Abstoßungsreaktionen sogar bei Implantation in nicht verwandte Empfänger.
| Mehr auf biotechnologie.de |
Förderung: Gezielter neue Herzmuskelzellen herstellen |
Dies ist ein klarer Vorteil gegenüber anderen Stammzellen“, sagt Michael Didié von der Universitätsmedizin Göttingen. Dieser Effekt hänge ursächlich damit zusammen, dass das Erbmaterial in aus Jungfernzeugung hervorgegangenen Zellen weniger variabel ist, als in gegengeschlechtlich gezeugten Embryonen. Das Team um Zimmermann will das therapeutische Potenzial der Parthenogenese auch für den Menschen überprüfen. Dafür braucht es menschliche unbefruchtete Eizellen. Allein in Deutschland werden nach der Statistik der Deutschen Gesellschaft für Reproduktionsmedizin jährlich etwa 60.000 unbefruchtete Eizellen verworfen, weil sie für eine künstliche Befruchtung schlussendlich nicht geeignet sind. Das bedeutet, dass für die geplanten Arbeiten keine zusätzlichen Eizellspenden nötig sind, sondern lediglich auf vorhandene, aber nicht mehr benötigte Eizellen zurückgegriffen werden kann. Eine weitere Vision der Göttinger Forscher sind Biobanken mit PS-Zelllinien. Modellrechnungen ließen den Schluss zu, dass 80 bis 100 unterschiedlichen PS-Zelllinien ausreichen würden, um eine Gewebereparatur ohne zusätzliche Immununterdrückung bei einer Bevölkerung von circa 100 Millionen zu erreichen.
© biotechnologie.de/pg
Nano-Bioanalytik-Zentrum in Münster eröffnet
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
- Das nun eröffnete Nano-Bioanalytik-Zentrum Münster soll der Nano-Bioanalytik zu neuen Geräte und Methoden verhelfen. Quelle: WFM / Martin Rühle
Nach zweijähriger Bauzeit ist das Nano-Bioanalytik-Zentrum Münster (NBZ) am 18. Februar feierlich eröffnet worden.
In dem neuen Gebäudekomplex sollen nun innovative Geräte und Methoden für die Nano-Bioanalytik entwickelt werden. Bis zu 100 neue Arbeitsplätze sollen in dem neuen Zentrum entstehen. Insgesamt 16,2 Millionen Euro flossen in den Bau des Gebäudes. Die Europäische Union förderte das Bauvorhaben mit 6,4 Millionen Euro, das Land NRW gab 3,8 Millionen Euro hinzu. Stadt und Wirtschaftsförderung Münster stellten jeweils 1,5 Millionen Euro zur Verfügung. Das vom Berliner Architekten Staab konzipierte Gebäude besteht aus mehreren jeweils 200 Quadratmeter großen chemischen, physikalischen und biologischen Modulen. Der Bedarf für so einen Bau war in der westfälischen Stadt offenbar vorhanden. Bereits bei Eröffnung waren rund zwei Drittel der Flächen vergeben. Vier Unternehmen und eine Abteilung des Universitätsklinikums, das die Biomaterialien für die Unternehmen liefert, sind Mieter im NBZ.
| Mehr auf biotechnologie.de |
Wochenrückblick: Spatenstich für Nano-Bioanalytik-Zentrum in Münster |
Für die Eröffnung war auch NRW-Wissenschaftsministerin Svenja Schulze in ihre Heimatstadt gekommen. Die Planung des NBZ hatte sie vor ihrer Berufung zur Ministerin noch als Aufsichtsratsvorsitzende der Wirtschaftsförderung begleitet. Sie betonte, das NBZ solle zukünftig als Motor für die Entwicklung von Technologieunternehmen dienen, die an der Schnittstelle zwischen Nano- und Biotechnik neue Produkte erforschen und produzieren. Das NBZ schließe damit eine Lücke zwischen den ebenfalls in Münster beheimateten Zentren für Nanotechnologie (CeNTech) und Biotechnologie (BioZ).
© biotechnologie.de/bk
Martinsrieder 4 SC AG kooperiert mit Mainzer BioNTech
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
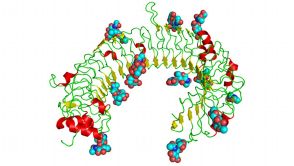
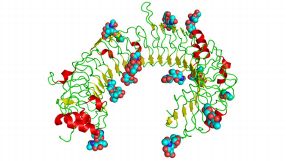
- Moleküle aus der Toll-like Rezeptorfamilie sind wie ein Hufeisen geformt. Eine Forschungskooperation will neue Wirkstoffe finden, um die Rezeptoren zu aktivieren. Quelle: Wikipedia/The cat
Die Martinsrieder 4SC AG hat mit dem Mainzer Unternehmen BioNTech eine umfassende Forschungszusammenarbeit begonnen.
Die bereits zu Jahresbeginn gestartete Partnerschaft mit der 4SC-Tochter „4SC Discovery“ sei auf drei Jahre angelegt und diene dazu, neue niedermolekulare Krebswirkstoffe zu identifizieren und zu optimieren, hieß es in einer Pressemitteilung vom 20. Februar. Im Rahmen der Vereinbarung erhält 4SC eine Vorabzahlung in Höhe von 2,5 Millionen. Euro für den zukünftigen Einsatz ihrer niedermolekularen TLR-Agonisten als Krebsimmuntherapie. Hinzu kommen ein aufwandsabhängiges Dienstleistungsentgelt sowie Meilensteinprämien und eine Umsatzbeteiligung. Im Gegenzug sichert sich BioNTech eine exklusive Lizenz für die weltweite Vermarktung der aus der Kooperation hervorgehenden TLR-Agonisten. Das Programm, bei dem Substanzen zur Aktivierung des Toll-like Receptors gesucht werden, befindet sich derzeit in einer frühen Entwicklungsphase.
| Mehr auf biotechnologie.de |
Wochenrückblick: 4SC: Positive Studiendaten zu epigenetischem Krebswirkstoff Wochenrückblick: Dank Tumorgenom zur Impfung gegen Krebs |
„Wir sind stolz, dass unsere Forschungstochter nur ein Jahr nach ihrem operativen Start einen ersten Deal für eine Frühphasen-Partnerschaft abgeschlossen hat“, sagte Ulrich Dauer, der Vorstandsvorsitzende der 4SC AG. Das Unternehmen aus Martinsried hatte seine Frühphasen-Forschung erst Anfang 2012 in ein eigenes Tochterunternehmen ausgegliedert, um die Erfahrungen in dem Segment auch externen Auftraggebern zur Verfügung zu stellen. Wie bei BioNTech gehören die Brüder Strüngmann auch bei 4SC zu den Hauptinvestoren. BioNTech ist ein Spin-off der Johannes Gutenberg-Universität Mainz. 2009 gegründet von GO-Bio-Preisträger Ugur Sahin spezialisiert sich die Firma auf die Entwicklung von molekularen Immuntherapien sowie von auf Biomarkern basierenden diagnostischen Ansätzen zur individualisierten Behandlung von Krebs und anderen schweren Erkrankungen.
© biotechnologie.de/bk