Schutzengel für Eiweiße in 3D nachgebaut
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
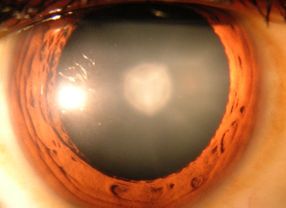
- Beim Grauen Star trübt sich die Augenlinse. Das wird hervorgerufen durch den Zerfall von Eiweißen. Schutz bieten Hitzschockproteine. Quelle: Rakesh Ahuja
07.08.2009 -
Die Linse im menschlichen Auge besteht aus unterschiedlichen dichtgepackten Eiweißen. Ihre Position am Lichteinfallstor des Körpers setzt sie gefährlicher ultravioletter Strahlung aus. Hitzeschockproteine wachen darüber, dass die Eiweiße in der Linse nicht durch die Strahlung zersetzt werden und damit unkontrolliert verklumpen. Geschieht das, kommt es zum "Grauen Star". Forscher um Johannes Buchner der Technischen Universität München (TUM) haben nun erstmals die dreidimensionale Gestalt eines solchen Schutzproteins aufgeklärt. Das könnte helfen, Eiweiße in Zukunft besser gegen Verfall zu schützen und damit neue Therapien zu entwerfen, so die Forscher im Fachblatt Proceedings of the National Academy of Science (PNAS, Online-Vorabveröffentlichung, 27. Juli 2009).
Eiweiße sind in der Zelle unverzichtbar. Sie sind die "molekularen Maschinen", die alles herstellen, was die Zelle benötigt. Im menschlichen Körper gibt es hunderte verschiedener Eiweiße. Die große Vielfalt rührt auch daher, dass sich Eiweiße, im Grunde lange Ketten aus Aminosäuren, zu sehr unterschiedlichen Gebilden formen. Sie falten sich ihrer jeweiligen Aufgabe gemäß nach einem komplexen Faltmuster. Verschlechtern sich die Umweltbedingungen, ist also die Zelle zu hoher Temperatur, ultravioletter Strahlung oder Schadstoffen wie Schwermetallen ausgesetzt, kann die Eiweiße beschädigen. Die raffinierte Faltung löst sich dann auf, die Aminosäureketten verkleben zu chaotischen Knäueln. Die Eiweiße sind denaturiert und können ihre Aufgaben nicht mehr wahrnehmen. In der Augenlinse ist die Gefahr für einen Zerfall noch größer als anderswo im Körper. Denn die Eiweiße der Linse werden im Laufe des Lebens nicht erneuert. Sie sind so alt wie der Mensch selbst.
Hitzschockproteine stabiliseren die Eiweiße
Damit das nicht passiert, treten Eiweiß-Schutzengel auf den Plan, die sogenannten Hitzeschockproteine. In Extremsituationen zellulären Stresses stabilisieren Hitzeschockproteine die Eiweiße in der Zelle, um sie vor Denaturierung zu schützen. Sind die Eiweiße schon unrettbar verloren, dann beschleunigen die Hitzeschockproteine den Abbau nicht mehr funktionsfähiger Proteine über das Enzym Proteasom.
Auch im normalen Zellalltag haben die Hitzschockproteine eine Schlüsselposition inne. Sie helfen neuen Eiweißen, die gerade produziert worden sind, bei der korrekten Faltung. Damit gehören sie zur Gruppe der sogenannten Chaperone, den "Anstandsdamen" der Zelle. Wie komplex die Faltung von Eiweißen in der Zelle ist, macht ein Film des Max-Planck-Instituts für Biochemie in Martinsried deutlich.
| Proteinforschung an der Technischen Universität München |
| An der Technischen Universität München beschäftigt sich das Department Chemie Biotechnologie unter Johannes Buchner mit der Faltung und Produktion von Eiweißen. Und ist Teil des Exzellenzclusters CIPSM. mehr Informationen: hier klicken mehr Informationen zum Exzellenzcluster CIPSM: hier klicken |
Anstandsdamen der Zelle
Chaperone sind nicht nur deswegen so wichtig, da sie in Zellen neu hergestellten Eiweißen ihre funktionelle Struktur geben, sondern haben noch weitergehende Bedeutung: Da Proteine nur als lange Aminosäurekette ohne jegliche Wasserstoff- und Disulfidbrückenbindungen die Tunnelproteine der Zellmembranen (z. B. in ein Mitochondrium) passieren können, müssen sie nach dem Durchqueren der Zellmembran wieder zurückgefaltet werden, sodass sie ihre Funktion wiedererlangen.
Je nach ihrer Größe werden Hitzeschockproteine in drei Gewichtsklassen eingeteilt. Die prominentesten Vertreter der Leichtgewichte unter den Hitzeschockproteinen sind alphaA-Crystallin und alphaB-Crystallin. Während alphaA-Crystallin im Wesentlichen in der Augenlinse vorkommt, ist alphaB-Crystallin auch im Gehirn sowie im Herz- und Muskelgewebe besonders häufig anzutreffen. In der Augenlinse wirken sie Krankheiten wie dem grauen Star entgegen. Fehlfunktionen von alphaB-Crystallin in Gewebezellen können zu Krebs und neurologischen Defekten wie Alzheimer führen.
| Mehr zum Thema auf biotechnologie.de |
| News: Alle Eiweiße der Hefe im Visier Menschen: Franz-Ulrich Hartl: Die Rolle der Anstandsdame unter den Eiweißen aufgeklärt |
Kugelförmige Struktur wie ein löchriger Fußball
Wegen ihrer großen medizinischen Bedeutung in der Zelle stehen die alpha-Crystalline im Mittelpunkt des Interesses vieler Wissenschaftler. Den Forschern um Johannes Buchner am Lehrstuhl für Biotechnologie der TU München gelang es nun, alphaA- und alphaB-Crystalline in gentechnisch veränderten Bakterien herzustellen und daraus einheitlich aufgebaute Komplexe zu gewinnen. Die Kollegen am Zentrum für Elektronenmikroskopie unterzogen die von den Biotechnologen gebauten Eiweiße einer eingehenden Analyse. Wie die Forscher nun im Fachmagazin PNAS berichten, konnten sie feststellen, dass alphaB-Crystallin entgegen früherer Annahmen eine definierte, kugelige Struktur aus 24 Untereinheiten bildet, die an einen löchrigen Fußball erinnert. Durch die große Oberfläche können viele Eiweiße vor dem Zusammenklumpen geschützt werden.
Dieser Film zeigt, wie Eiweiße in ihre dreidimensionale Form gefaltet werden.Quelle: Max-Planck-Institut für Biochemie
Durch die Ermittlung der dreidimensionalen Struktur des alphaB-Crystallins, die derzeit verfeinert wird, ist nun die Grundlage geschaffen, gesunde und krankheitsfördernde Mutanten zu vergleichen und so deren Funktionsweise aufzuklären. Die Wissenschaftler hoffen, auf diese Weise besser zu verstehen, wie Eiweiße geschützt werden können. Das könnte zu neuen Therapieansätzen bei Krankheiten führen, die wie der Graue Star von degenerierten Eiweißen verursacht werden.
Zeitgleich zu den Arbeiten in München haben US-amerikanische Forscher an der Case Western Reserve University in Cleveland die genetische Ursache für eine erhöhte Anfälligkeit gegenüber dem Grauen Star entdeckt. Das Gen EphA2 enthält den Bauplan für ein Enzym, das geschädigte Eiweiße in der Linse repariert. Fehlt es bei Mäusen, bekommen diese es im Alter vermhert mit Grauem Star zu tun. Beim Menschen haben die Forscher mit diesen Erkenntnissen nun schon einige Mutationen des EphA2-Gens bei Patienten mit Grauem Star identifizieren können. Wie sie im Online-Fachjournal Public Library of Science Genetics (31. Juli 2009) berichten, wollen die Forscher nun die genauen Mechanismen dieser Mutationen erforschen.