Erblindung: Optogenetik liefert neue Therapieoptionen
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
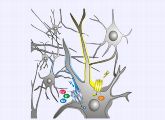
- Die Sanofi-Tochter Fovea Pharmaceuticals will Erkenntnisse aus der Optogenetik nutzen, um neue Augenmedikamente zu entwickeln. Quelle: Marcus Meyer/jugendfotos.de
20.09.2011 -
Das noch junge Forschungsgebiet der Optogenetik könnte ganz neue Behandlungsmöglichkeiten für Augenkrankheiten eröffnen, die zur Erblindung führen. Mit lichtgesteuerten molekularen Schaltern wollen die Forscher Nervenzellen zu Lichtsinneszellen umbauen, so dass sie wieder optische Reize wahrnehmen. Die Pharmaindustrie steigt nun ebenfalls in das Feld ein. Gemeinsam mit Forschern des Max-Planck-Instituts für Biophysik in Frankfurt will der Pharmakonzern Sanofi den Therapieansatz genauer erforschen.
Die Optogenetik verwendet lichtempfindliche Schalter-Proteine, um mit ihrer Hilfe das Verhalten von Zellen präzise von außen zu steuern. Das Feld ist noch jung, doch schon jetzt zeichnet sich ab, dass die neue Technik die Neurowissenschaften und die Zellbiologie revolutionieren könnte. So kürte das Fachblatt Nature Methods die Technik zur Methode des Jahres 2010 (mehr…). Die Wissenschaftler um Ernst Bamberg, dem Leiter der Abteilung Biophysikalische Chemie am Max-Planck-Institut für Biophysik in Frankfurt gehören zu den Pionieren auf diesem Gebiet. Sie entdeckten 2002 bestimmte lichtgesteuerte Ionenkanäle in Nervenzellen, sogenannte Channelrhodopsine.
| Mehr auf biotechnologie.de |
News: Max-Planck-Gesellschaft stellt Forschungsfelder mit Zukunft vor Wochenrückblick: Optogenetik - Mit Licht das Herz ins Stolpern gebracht Menschen: Alexander Gottschalk - Fadenwürmer mit Licht fernsteuern |
Mit Algenprotein Nervenzellnetzwerke ein- und ausschalten
Eigentlich stammen die lichtgesteuerten Kanalproteine aus der Zellmembran der einzelligen Grünalge Chlamydomonas reinhardtii. Sie ermöglichen es der Alge, Helligkeit wahrzunehmen und sich zum Licht hin oder davon weg zu bewegen. Eine ganz besondere Eigenschaft macht die Kanäle aber auch für die Wissenschaft interessant: Werden die Channelrhodopsine belichtet, lassen sie positiv geladene Teilchen die Membran passieren, wodurch an der Zellmembran ein elektrisches Signal ausgelöst wird. Wissenschaftler können die Proteine heute auf molekulargenetischem Weg in Zellen einschleusen und so einzelne elektrisch erregbare Nervenzellen oder Nervenzellnetzwerke in Kultur und im lebenden Tier mit Licht an- und ausschalten.
Genau diese Proteine haben jetzt auch das Interesse des Pharmakonzerns Sanofi geweckt. Gemeinsam mit den Forschern um Bamberg will die Sanofi-Tochter Fovea Pharmaceuticals die Kanäle nun so weiterentwickeln, dass sich damit Nervenzellen der Netzhaut im menschlichen Auge in Lichtsinneszellen verwandeln lassen. Patienten, deren Sinneszellen zerstört sind, könnten so wieder optische Reize wahrnehmen. Zu diesem Zweck haben die Technologietransfer-Organisation der Max-Planck-Gesellschaft, die Max-Planck-Innovation GmbH, und Fovea Mitte September eine entsprechende Lizenzvereinbarung geschlossen. Für die auf drei Jahre ausgelegte Zusammenarbeit stellt Fovea Einstands- und Lizenzzahlungen von bis zu 26,4 Millionen Euro in Aussicht. Vereinbart wurde außerdem eine Umsatzbeteiligung an eventuellen Produktverkäufen. Hinzu kommen Forschungsbeihilfen für Bambergs Arbeiten von 450.000 Euro. Fovea wiederum erhält die weltweiten Exklusivrechte und sichert sich weltweite Rechte an den Ergebnissen der Zusammenarbeit.
In dieser Folge der Kreidezeit erklären wir, wie sich Zellen mit Licht steuern lassen.Quelle: biotechnologie.de
Nervenzellen ohne Elektroden steuern
Die Forscher hoffen, mit einem auf den Channelrhodopsinen basierenden gentherapeutischen Ansatz Schäden der Netzhaut reparieren zu können. Bei Erbkrankheiten wie Retinitis pigmentosa, aber auch bei Netzhautdystrophien sowie Glaukomen, altersbedingter Makuladegeneration und diabetischer Retinopathie sind diese Schäden bisher für den Sehkraftverlust verantwortlich. Die Wissenschaftler sind von den Möglichkeiten der Channelrhodopsine fasziniert: „Jetzt können wir erstmals ohne Elektroden und ohne jedwede chemische Modifizierung die Aktivität von Nervenzellen störungsfrei und mit bisher nicht erreichter hoher Ortsauflösung einfach durch Licht steuern."
© biotechnologie.de/bk