Bauanleitung für sensible molekulare Spürnase
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
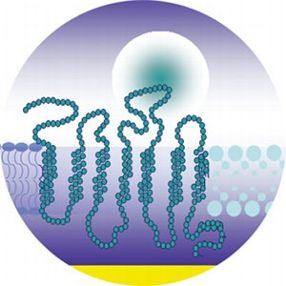
- So sieht die künstliche Zellwand aus, die die Mainzer Forscher hergestellt haben: Ein Geruchsrezeptor - hier als lange Kette gezeichnet - bindet an ein kugelförmiges Geruchsmolekül. Quelle: Max-Planck-Institut für Polymerforschung
16.02.2007 -
Wer eine sensible molekulare Spürnase in einem Biosensor entwickeln will, hatte bisher mit etlichen Schwierigkeiten zu kämpfen: komplexe Geruchsrezeptoren ließen sich nur schwer nachbauen und in eine künstliche Oberfläche einbetten. Ein Forscherteam um Eva-Kathrin Sinner vom Max-Planck-Institut für Polymerforschung in Mainz hat dieses Problem nun gelöst. Im Fachmagazin Angewandte Chemie (15. Januar 2007) hat die 35-jährige Wissenschaftlerin eine neue Methode vorgestellt, mit der sich ein wichtiger Vertreter dieser Geruchsrezeptoren im Reagenzglas herstellen und in eine künstliche Zellmembran einbauen ließ. Diese Erkenntnisse ebnen den Weg für eine neue Generation von Biosensoren, die Gifte, Sprengstoffe oder Drogen nachweisen können. Darüber hinaus erleichtert das Verfahren auch die Suche nach neuen Wirkstoffen in der Pharmaforschung.
Der Riechvorgang beim Menschen ist auf molekularer Ebene ein ziemlich komplexer Vorgang. Er beginnt in der oberen Nasenhöhle, wo die einzelnen Duftmoleküle über die auf der Riechschleimhaut angesiedelten Sinneszellen aufgenommen werden. Diese Aufnahme ist mit einer Computertastatur vergleichbar: Man stelle sie sich als spezialisierte Sinneszelle vor und die einzelnen Tasten als Geruchsrezeptoren. Mit diesen Außenantennen, die aus einer Kette von Eiweißen aufgebaut und so mit der Zelloberfläche verwoben sind, dass nur noch die Enden nach außen ragen, fängt die Zelle entsprechende Geruchsmoleküle ein. Allein beim Menschen existieren hunderte verschiedene solcher Geruchsrezeptoren, die alle auf jeweils unterschiedliche Geruchsmoleküle ausgerichtet sind. Kommt ein solcher Rezeptor in Kontakt mit „seinem“ spezifischen Geruchsmolekül, wird er aktiviert und gibt so das Signal durch die Zellwand ins Innere der Zelle weiter – ganz ähnlich einer Taste, die gedrückt wird. Das dabei entstehende Signal wird wiederum über eine Vielzahl von Nervensträngen zum Gehirn gesendet, einem Tastaturkabel gleich, das mit dem Computer verbunden ist.
Problem für die Forschung: Enge Verbindung zwischen Eiweiß und Zellwand
Ähnlich wie bei den Sinneszellen gibt es auch auf allen anderen Zellen Rezeptoren, die sich auf der Oberfläche befinden und dort als Türsteher und Wächter für die Zelle agieren, dabei Signale von außen nach innen senden oder bestimmten Eiweißen oder anderen Stoffen Einlass in die Zelle gewähren. Auch sie sind buchstäblich wie Knöpfe in der Tastatur mit der Zellwand (Zellmembran) verflochten und genau diese enge Verbindung machte es Wissenschaftlern in den vergangenen Jahren äußerst schwer, die Mechanismen solch komplexer Membraneiweiße in vitro genauer zu untersuchen. Dafür müssen sie normalerweise aus der Zelle herausgelöst, vervielfältigt und im Reagenzglas nachgebaut werden. Weil sie aber mit der Zellwand verwoben sind, gestaltet sich diese Vorgehensweise als schwierig: Bisher blieb den Forschern deshalb nichts anderes übrig, als solche Eiweißstrukturen durch die Zerstörung der Zellwand regelrecht herauszuwaschen. Dabei ging jedoch ihre Funktionsfähigkeit verloren, weil diese recht grobe Prozedur die besondere Faltstruktur der Eiweiße zerstört, die für die biologische Aktivität wichtig ist. Dies wäre in etwa so, also ob man die Funktionsweise der Shift-Taste untersuchen will und dabei die Tastatur mit einem Hammer zerschlägt.
Geruchsrezeptor mit voller Funktion nachgebaut
Wie Wissenschaftler um Eva-Kathrin Sinner vom Max-Planck-Institut für Polymerforschung in Mainz nun im Fachmagzain Angewandte Chemie (Ausgabe 118, 15. Januar 2007) berichten, haben sie am Beispiel von speziellen Geruchsrezeptoren bei Wanderratten einen Ausweg aus dem Dilemma gefunden: Für diese komplexen Membraneiweiße, die zur Klasse der G-gekoppelten Proteine (GPCR) gehören, haben die Forscher eine Bauanleitung vorgelegt, mit der sie sich im Reagenzglas mit einer natürlichen Faltung herstellen und in eine künstliche Zelloberfläche einbauen lassen - ein kompliziertes Auswaschen aus einer Zellwand ist damit nicht mehr nötig. Die Wissenschaftler hatten dafür ein zweischichtiges Lipidmembransystem entwickelt, das natürlichen Zellmembranen ähnlich ist, und boten es den Eiweißen schon ganz am Anfang ihres Herstellungsprozesses an. Wie die Wissenschaftler zeigen konnten, fädelten sich die Eiweißketten mit diesem Verfahren Stück für Stück in die künstliche Zellwand ein und am Ende hatten die Forscher komplett künstlich hergestellte, biologisch aktive Membraneiweiße. Damit können die natürlichen Funktionen dieser Rezeptoren nun erstmals detailliert in vitro untersucht werden. Die Zellmembran, in die die Rezeptoren eingebettet sind, haftet dabei an einer Goldschicht, und kann so beliebig eingesetzt und untersucht werden. Ob die so eingebauten Rezeptoren auch tatsächlich spezifisch „ihre“ Moleküle erkennen können, zeigt dabei ein einfacher Test: Bindet ein Molekül wie im Schlüssel-Schloss-Prinzip an seinen spezifischen Rezeptor auf der Membran, verändern sich die Absorptions- und Reflexionseigenschaften der künstlichen Membran. Diese winzigen Veränderungen können mit einem Spektrometer nachgewiesen werden.
Arbeit mit Forschungspreis der Peter und Traudl Engelhorn-Stiftung ausgezeichnet
„Wir haben jetzt praktisch eine Gebrauchsanweisung, wie man bisher schwer zugängliche Membranproteine in ihrer aktiven Struktur herstellen und untersuchen kann“, freut sich die erst 35-jährige Forscherin, die für diese Arbeit mit dem diesjährigen, auf 10.000 Euro dotierten Forschungspreis der Peter und Traudl Engelhorn-Stiftung zur Förderung der Biotechnologie und Gentechnik ausgezeichnet wurde. Damit soll das große Potential des neuen Verfahrens gewürdigt werden: Pharmafirmen können nun erstmals detaillierte in vitro Analysen von GPCRs und ihrer natürlichen Funktionen durchführen, die in der Wirkstoffforschung zu den wichtigsten Angriffszielen von neuen Medikamenten gehören. Gleichzeitig ebnen die Erkenntnisse der Max-Planck-Forscher den Weg für eine neue Generation von sehr sensiblen Biosensoren, die Gifte, Sprengstoffe oder Drogen nachweisen können.