Sehrezeptor in Aktion geblitzt
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
- Ohne spezielle Rezeptoren wäre die Sehfähigkeit des Menschen deutlich eingeschränkt. Berliner Forscher haben einen solchen Sehrezeptor nun untersucht. Quelle: Pascal Tippelt/pixelio.de
14.04.2011 -
Der Mensch besitzt die Fähigkeit, äußere Reize zu empfangen und sie als elektrische Signale an das Gehirn zu schicken. Hierfür sind spezielle Antennen entscheidend – die G-Protein gekoppelten Rezeptoren. Der wohl bekannteste Vertreter dieser Proteinfamilie ist Rhodopsin – er ist beim Menschen unter anderem für das Hell-Dunkel-Sehen verantwortlich. Ein Forscherteam um Klaus Peter Hoffmann und Patrick Scheerer von der Charité Universitätsmedizin Berlin konnte nun erstmals klären, wie ein solches Eiweiß beschaffen sein muss, um ein Lichtsignal aufnehmen zu können. Wie sie in der Fachzeitschrift Nature (2011, Vol. 471, S. 651–655) berichten, könnten ihre Erkenntnisse möglicherweise die Grundlage für neue therapeutische Ansätze bilden. Denn G-Protein gekoppelte Rezeptoren kommen an vielen Stellen des Körpers vor.
Sehen, riechen, schmecken, fühlen – vier unverzichtbare Sinne. Verantwortlich für den Empfang der Licht-, Geruchs-, oder Geschmacksreize im menschlichen Körper sind spezielle Antennen: sogenannte G-Protein gekoppelte Rezeptoren. Diese spielen auch bei vielen Krankheiten, wie etwa bei Entzündungsprozessen, eine entscheidende Rolle. Daher wirken etwa 60 Prozent aller verschreibungspflichtigen Medikamente über solche G-Protein-gekoppelten Rezeptoren – dazu gehören unter anderem Betablocker, Antihistaminika oder Opioide.
| Mehr auf biotechnologie.de |
News: Strukturbiologischer Schnappschuss vom Sehen News: Bauanleitung für sensible molekulare Spürnase News: Gentherapie für Netzhaut Förderbeispiel: Zellfreie Manufaktur für Biomoleküle |
Rezeptoren: Signal empfangen, verarbeiten und weiterleiten
Aufgrund der vielseitigen Bedeutung dieser Rezeptoren für den Menschen wollen Wissenschaftler verstehen, wie diese Antennen überhaupt Signale erkennen, weiterverarbeiten und schließlich weiterleiten. Wissenschaftler um Klaus Peter Hofmann, stellvertretender Direktor des Instituts für Medizinische Physik und Biophysik der Charité Universitätsmedizin, forschen daher schon seit Jahren an den Zellrezeptoren. Genauere Kenntnisse über ihre dreidimensionale Struktur, so die Hoffnung, könnten helfen, die Effizienz vieler Therapien zu steigern oder ganz neue Therapieansätze zu entwickeln. Mehrere tausend verschiedene Rezeptoren sind bei Säugetieren schon entdeckt worden, somit stellen G-Protein-gekoppelte Rezeptoren die größte Familie der Zellrezeptoren dar.
Ihre Arbeit ist dabei mit dem An- oder Ausschalter einer Maschine vergleichbar. Da die Rezeptoren in den Membranen liegen, die jede lebende Zelle umhüllen, dienen sie oft als Andockstation der Zelle und vermitteln Informationen von außen ins Zellinnere. Das passiert aber nur, wenn ein Signalmolekül an den Rezeptor bindet – dann ist er angeschaltet. Die aktivierenden Liganden – so werden die Stoffe bezeichnet, die an einen Rezeptor binden können – sind sowohl in ihrer Struktur als auch in ihrer Funktion höchst unterschiedlich. Aber trotz der chemischen und funktionellen Vielfalt haben alle G-Protein gekoppelten Rezeptoren etwas gemein. „Das An- und Ausschalten passiert nach einem bestimmten Mechanismus, und das Grundprinzip ist immer ähnlich, unabhängig davon, wie der Ligand aussieht“, sagt Charité-Forscher Patrick Scheerer. Für die Wissenschaftler ist das von großer Bedeutung. „Wenn man einen Modellrezeptor versteht, kann man immer zurückschließen auf andere Rezeptoren“, so der Biophysiker.
Ein Lichtreiz wird zum Nervenreiz
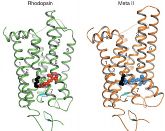
Die Berliner konzentrieren sich auf den Sehrezeptor Rhodopsin, der für das Hell-Dunkel-Sehen verantwortlich ist. Für die Wissenschaft ist dieser Rezeptor ein gutes Modellsystem zur Erforschung G-Protein gekoppelter Rezeptoren. Das liegt zum einen daran, das er leicht zugänglich ist. Die Forscher präparieren Rhodopsin aus Rinderaugen, die sie von Schlachthöfen beziehen. „Rhodopsin lässt sich auch einfacher aktivieren als andere Rezeptoren - nämlich mit Licht“, so Scheerer.
Über den mehrstufigen Prozess des Sehvorgangs, der mithilfe des Rhodopsins abläuft, darüber wissen die Wissenschaftler grob bereits Bescheid. Zunächst fällt durch das Auge Licht auf den Liganden. Mit dem Lichtreiz verändert dieses Signalmolekül (das Retinal) seine Form und bewirkt, dass sich das Rezeptorprotein Opsin in seiner Form verändert. Die Folge: Das im Zellinneren an die Zellmembran gekoppelte G-Protein wird aktiv und löst innerhalb weniger Millisekunden eine kaskadenartige Verstärkung des Signals über mehrere Stationen aus. Der eigentliche Lichtreiz wird so in einen Nervenreiz umgewandelt, der wiederum ins Sehzentrum des Gehirns geleitet wird, wo schließlich ein Bild entsteht.
| Institut für Medizinische Physik und Biophysik, Charité Universitätsmedizin |
Das IMPB besteht an der Berliner Charite Universitätsmedizin seit achtzig Jahren. Am Institut sind neben Physikern auch Mediziner, Chemiker, Biochemiker, Biotechnologen und Biologen tätig. |
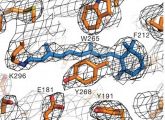
Welche Auswirkungen einzelne Prozesse in diesem Vorgang auf die jeweiligen Rezeptorbausteine haben, das konnte bisher noch niemand genau sagen. So wollen die Forscher zum Beispiel herausfinden, wie sich die Struktur des Rezeptors genau dann verändert, wenn das Retinal aktiviert wird. Das Problem: Solche Rezeptoren lassen sich nur schwer in eine stabile Form überführen, die mikroskopisch untersucht werden kann. Dieser Prozess der Kristallisierung von Rhodopsin steht deshalb im Mittelpunkt der Berliner Arbeiten. 2008 schließlich gelang den Forschern um Klaus Peter Hofmann ein kleiner Durchbruch: Zusammen mit Scheerer und einigen Kollegen aus Großbritannien, Südkorea und Kanada konnten sie einen „Schnappschuss“ des Rhodopsins einfangen, während im Zellinneren ein G-Protein am Rezeptor angedockt war. Aber auch dieses Bild zeigte den Rezeptor nur in seinem inaktiven Zustand.
Schnappschuss im Standby-Modus
Mit der aktuellen Veröffentlichung sind die Berliner Wissenschaftler nun einen weiteren Schritt vorangekommen: Zum ersten Mal haben sie den Lichtrezeptor Rhodopsin in einem aktiven Standby-Modus stabilisiert – und zwar zu genau dem Zeitpunkt, als der Ligand (das Retinal) in seiner durch den Lichtreiz umgewandelten Form an das Rezeptorprotein (Opsin) bindet. „Einen solchen Meta-Zustand zu halten, ist das entscheidende Problem, denn er ist nur ein kurzer Übergangszustand“, beschreibt Scheerer die Schwierigkeit dieser Phase. Gelungen ist es den Forschern dadurch, dass sie die natürliche Aktivierung des Rezeptors durch das Retinal nachgestellt haben. Dazu kristallisierten sie das Opsin und bauten das lichtaktivierte Retinal nachträglich ein. „Wir haben das Molekül zusammen mit dem Opsinkristall in Lösung gegeben, dabei legt es sich in die Struktur des Rezeptors und verknüpft sich wieder mit ihm“, so Scheerer. Diesen Zustand haben die Wissenschaftler schließlich bei etwa minus 170 Grad eingefroren. Auf diese Weise konnten sie die dreidimensionale Struktur des Rezeptors im aktivierten Zustand mithilfe der Röntgenstrukturanalyse errechnen. „Somit haben wir erstmals einen Einblick in den Mechanismus der Wechselwirkung zwischen dem Rezeptor und seinem Liganden erhalten“, sagt Scheerer.
Informationen für neue therapeutische Ansätze
Für die Forscher bedeutet das einen wesentlichen Fortschritt. „Man kann aus unserem Beispiel lernen, wie die Signalübertragung von einem Liganden in ein Rezeptorprotein überhaupt vor sich gehen kann“, erklärt Hofmann. „Wir glauben, dass die prinzipiellen Vorgänge bei der Ligandenbindung für verschiedene Rezeptoren ähnlich sind.“ Er selbst ist inzwischen pensioniert, doch das Team um Scheerer wird auch künftig weiter an den G-Protein gekoppelten Rezeptoren arbeiten, um die Aktivierungsvorgänge am Live-Modell noch besser zu verstehen. Ihr Ziel: Den gesamten Rezeptorkomplex mitsamt G-Protein zu kristallisieren. „Vom Verständnis einer der wichtigsten Reaktionen in der eukaryotischen Biologie erhoffen wir uns auch entscheidende Hinweise darauf, wie sich krankhafte Mechanismen behandeln lassen“, so Scheerer.
© biotechnologie.de/tk