Nobelpreis für Chemie 2008: Grünes Licht für die Forschung
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
- Eine Fruchtfliege leuchtet unter ultraviolettem Licht grün. Die vorderen Flügelbereich bleiben dunkel, weil hier das GFP nicht aktiv ist. Quelle: FU Berlin
Der Hallimasch-Pilz, der Vampir-Tintenfisch und die Qualle Aequorea victoria, sie alle haben eines gemeinsam: Sie leuchten. Biolumineszenz heißt das Phänomen, wenn Tiere oder Pflanzen mit der Abgabe von Licht auf sich aufmerksam machen. Aequorea victoria hat es nun zu besonderer Beachtung gebracht. Ihr internes Beleuchtungssystem arbeitet mit Hilfe eines „grün fluoreszierenden Proteins“, kurz GFP. Für dessen Erforschung haben drei Wissenschaftler den Nobelpreis für Chemie 2008 erhalten.
Das Werkzeug
Die Schwedische Akademie der Wissenschaften würdigte den Japaner Osamu Shimomura sowie die Amerikaner Martin Chalfie und Roger Tsien, weil sie der Biotechnologie zu einem ihrer wertvollsten Werkzeuge verhalfen. Mit dem Eiweiß GFP können Vorgänge in der Zelle, die ansonsten unmerklich ablaufen, sichtbar gemacht werden.
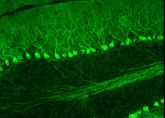
In jeder Zelle gibt es Dutzende von Proteinen mit den unterschiedlichsten Aufgaben. Sie alle sind eingebunden in einen Stoffwechselkreislauf, der außerordentlich komplex ist. Wer nun ein einzelnes Eiweiß auf seinen Wegen durch die Zelle zu verfolgen und dessen Funktion herauszubekommen möchte, verliert das Objekt seines Interesses schnell aus den Augen und damit den Überblick. Es wäre hilfreich, wenn einzelne Eiweiße wie Schiffe auf hoher See ihre Positionslampen auf Kommando anschalten könnten, damit sie in der dunklen Zelle einfach zu erkennen sind. Genau das bewirkt nun das GFP. Alles, was mit ihm verknüpft wird, leuchtet hell und grün, wenn es unter eine UV-Lampe gehalten wird.
Das Besondere an GFP im Vergleich zu anderen leuchtenden Eiweißstoffen ist, dass es keine zusätzlichen Chemikalien braucht, um zu fluoreszieren. Aufgrund dieser Eigenschaft ist es auch so gut geeignet, die Vorgänge innerhalb einzelner Zellen zu erforschen, die durch die Zugabe von Chemikalien möglicherweise gestört würden. So konnte mit Hilfe von GFP schon geklärt werden, wie sich Krebszellen ausbreiten oder wie bei der Demenzerkrankung Alzheimer nach und nach immer mehr Nervenzellen im Gehirn geschädigt werden.
Die Entdeckung
Wie bei so vielen anderen großen Entdeckungen führte auch beim GFP der Zufall Regie. An der japanischen Nagoya Universität rätselten die Wissenschaftler, warum der Muschelkrebs Cypridina leuchtete, wenn man ihn zerstückelte und anschließend mit Wasser übergoss. Keiner der Doktoranden wagte sich an das Problem heran, und so wurde der junge Assistent Osamu Shimomura mit der Aufgabe betraut, da für ihn kein Doktortitel auf dem Spiel stand. Schon nach einem Jahr konnte er Erfolg melden. Er isolierte einen Eiweißstoff, der in Reinform 37 000-mal heller leuchtete als in dem Muschelkrebs.
Das brachte Shimomura an die Princeton University in New Jersey. Die nächsten Monate verbrachte er damit, an der Westküste der USA Tausende von fluoreszierenden Quallen der Art Aequorea victoria aus dem Wasser zu fischen und durch einen Filter zu pressen. Übrig blieben wenige milligramm eines Eiweißstoffs, "der im Sonnenlicht grünlich leuchtet, unter einer Glühbirne gelblich und unter UV-Licht grün fluoresziert", wie er in der Veröffentlichung seiner Ergebnisse schrieb. Shimomura nannte die Substanz das "Grüne Protein". Später wurde das "Grün Fluoreszierende Protein" daraus. GFP war entdeckt.
Die Weiterentwicklung
Ohne die Forschungen Shimomuras hätte sich die "GFP-Revolution" in der Molekularbiologie wahrscheinlich um Jahrzehnte verzögert, schreibt das Nobelkomitee in seiner Begründung. Anteil an dieser Revolution hatte aber nicht nur Shimomura selbst. Mehr und mehr Wissenschaftler begannen sich für das Eiweiß zu interessieren.
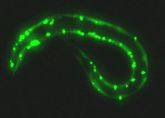
Doch es war Martin Chalfie von der Columbia University in New York, der das volle Potenzial des GFP für die Gentechnik erschloss. Chalfie interessierte sich 1992 für die Entwicklung des Nervenssystems beim Fadenwurm Caenorhabditis elegans, ein wegen seines relativ simplen Aufbaus schon damals beliebter Modellorganismus unter Forschern. Chalfie schleuste das Gen mit dem Bauplan für den leuchtenden Eiweißstoff in das Erbgut von Caenorhabditis elegans ein. Bei der Fortpflanzung gab der Wurm das Leuchteiweiß an seine Nachkommen weiter. Als aus den Eiern neue Würmer schlüpften, konnte Chalfie aufgrund des grünen Leuchtens genau verfolgen, wo bestimmte Eiweißstoffe bei der Entwicklung des Wurms zu welchem Zeitpunkt produziert werden.
Nicht nur in Würmern, auch in Kolibakterien ließen sich auf diese Weise Proteine markieren. Die Gruppe um Chalfie hatte somit der Forschung ein Verfahren bereitgestellt, die verschiedensten Gene gezielt mit GFP zu verknüpfen. Dadurch wurde es möglich, das Vorkommen bestimmter Proteine in Zellen und Geweben zu untersuchen, und das sogar während unterschiedlicher Entwicklungsstadien.
Dem dritten Nobepreisträger, Roger Tsien, gelang es, die Farbpalette des GFP zu ewrweitern. Er schuf neue Varianten, die bei unterschiedlichen Wellenlängen angeregt werden und deshalb blau, gelb und rot leuchten. Das erreichte Tsien durch gezielte Veränderungen im genetischen Bauplan des Eiweißes. Dies ermöglicht es Wissenschaftlern in aller Welt heute, verschiedene Eiweißstoffe in unterschiedlichen Farben zu markieren und dann gleichzeitig in ein und demselben Versuch zu beobachten.
Inzwischen wird GFP aber nicht nur in der Grundlagenforschung eingesetzt. Unter anderem wird es benutzt, um in Südostasien giftiges Arsen im Trinkwasser aufzuspüren. Auch Schwermetalle wie Kadmium oder Zink oder die hochgiftige Chemikalie TNT können mit Hilfe von GFP sichtbar gemacht werden. Der Leuchtstoff aus der Qualle ist inzwischen so gut erforscht, dass er sogar bei der Herstellung von leuchtendem Spielzeug eingesetzt wird.
Die drei Preisträger
Osamu Shimomura, 1928 in Kyoto geboren, studierte Pharmazie in Nagasaki. Vier Jahre lang war er daraufhin Assistent von Shungo Yasunaga an der Pharmazie-Abteilung der Universität Nagasaki. Nach seiner Promotion, 1960, wechselte er an die Princeton University in New Jersey, wo er 1965 bis 1982 forschte. 1982 bis 2001 war er Honorarprofessor an der Boston University und Forscher am Meeresbiologischen Laboratorium Woods Hole. Seit 2001 betreibt er sein privates Photoproteine Laboratory.
Martin Chalfie, 1947 geboren und in Chicago aufgewachsen, wurde an der Harvard University in Cambridge (Massachusetts) in Physiologie promoviert. Seit 1982 ist er außerordentlicher Professor für Biologie an der Columbia University. Später wurde er dort William-R.-Kenan-Jr.-Professor für Biologie.
Roger Tsien wurde als Sohn eines Ingenieurs und einer Krankenschwester in New York geboren. 1968 gewann er den ersten Preis der Westinghouse Science Talent Search für Untersuchungen zur Bindung von Metallen an Thiocyanate. Er studierte Chemie und Physik an der Harvard University, wo er 1972 seinen Bachelor machte. Dann ging er zum Physiologen Richard Adrian ans Churchill College der Universität Cambridge, wo er 1977 promoviert wurde. Anschließend war er Postdoktorand am Gonville and Caius College. 1981 wechselte er als Assistenzprofessor an die Abteilung Physiologie und Anatomie der University of California, Berkeley. 1985 bis 1987 war er dort außerplanmäßiger Professor und 1987 bis 1989 ordentlicher Professor. Seit 1989 ist er Professor für Pharmakologie, Chemie und Biochemie an der University of California, San Diego und Forscher am Howard Hughes Medical Institute.