Riesiges Atmungsprotein mit einer Million Atomen durchleuchtet
-
 <ic:message key='Bild vergrößern' />
<ic:message key='Bild vergrößern' />
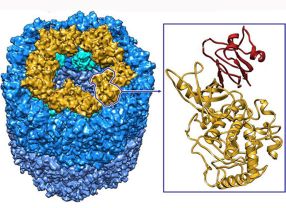
- Die 3D-Elektronenmikroskopie erstellte das Modell des KLH-Moleküls (links), die Röntgenstrukturanalyse lieferte die Feinstruktur des Kragenbausteins (Kasten). Quelle: Universität Mainz
01.07.2010 -
Die Schlüssellochnapfschnecke Megathura crenulata lebt vor der Küste Kaliforniens. Mediziner kennen das Weichtier, weil sie für den Sauerstofftransport im Blut auf ein ungewöhnlich großes Protein setzen, das Hämocyanin. Es ruft beim Menschen starke Immunreaktionen hervor, weshalb es als Verstärker zum Beispiel bei der Immuntherapie von Tumoren eingesetzt wird. Forscher der Johannes Gutenberg-Universität Mainz haben jetzt mit einer Kombination von modernen bildgebenden Verfahren die Gestalt des Proteins geklärt. Es besteht aus einer Million Atomen, 68.000 Aminosäuren, einem zylindrischen Körper und einem kragenförmigen Deckel, wie sie im Biochemical Journal (2010, Bd. 426, S. 373–378) berichten.
Wer vor der Küste Südkaliforniens oder Mexikos schnorcheln geht, könnte ihr begegnen: Die Große Kalifornische Schlüssellochnapfschnecke Megathura crenulata lebt in Wassertiefen von drei bis 40 Metern, wo sie vor allem nachts den Untergrund nach Algen und Manteltieren absucht. Ihren Namen hat die Familie der Schlüssellochschnecken von der charakteristischen Öffnung im Rückenschild. Das Loch dient der Fortpflanzung, der Verdauung und der Atmung. Dass M. crenulata weit über die Zirkel der Tauchbegeisterten hinaus bekannt ist, liegt allerdings an ihren inneren Werten. Sie verfügt über ein ungewöhnlich großes Protein für den Sauerstofftransport, für das sich Biologen, Mediziner und Pharmazeuten interessieren.
Zylinder mit Kragen an beiden Enden
Das „Keyhole Limpet Hämocyanin“ (KLH) gehört zu den blauen Blutproteinen, die bei Schnecken, Tintenfischen, Spinnen und Krebsen den Transport von Sauerstoff im Körper bewältigen. Bei blauen Blutfarbstoffen wird der Sauerstoff nicht wie beim menschlichen Hämoglobin in den roten Blutkörperchen mit Eisen gebunden, sondern mit Kupfer. Eine weitere Besonderheit von KLH ist die ungewöhnliche Größe. Es hat einen Durchmesser von riesenhaften 35 Millionstel Millimeter. Im Elektronenmikroskop erscheint das KLH-Molekül als Hohlzylinder mit einem Kragen an beiden Enden. Wie die einzelnen Aminosäurebausteine allerdings genau angeordnet sind, das war bisher unbekannt.
Mit einem Mix aus hochmodernen Methoden haben Strukturbiologen der Johannes Gutenberg-Universität Mainz KLH jetzt genau unter die Lupe genommen und die Gestalt bis ins kleinste Detail aufgeklärt. Zum Einsatz kamen dabei Sequenzanalyse, 3D-Elektronenmikroskopie und Röntgenkristallographie. Den jetzt im Fachblatt Biochemical Journal (2010, Bd. 426, S. 373–378) veröffentlichten Ergebnissen zufolge besteht das Riesenprotein aus rund 68.000 Aminosäuren, insgesamt zählt das Gebilde damit mehr als 1 Million Atome.
Tausende elektronenmikroskopischer Bilder
„Wir hatten am Institut für Zoologie die komplette Aminosäuresequenz des KLH ermittelt und herausgefunden, dass es aus 8 verschiedenen Proteinbausteinen besteht, die sich in dem Riesenmolekül 20 Mal wiederholen. Nun interessierte uns seine genaue dreidimensionale Struktur“, erläutert Jürgen Markl. Erst an der räumlichen Struktur lässt sich erkennen, wie die einzelnen Bausteine des Riesenproteins zueinander stehen, wie der Mechanismus zur Aufnahme und Abgabe von Sauerstoff genau funktioniert und wie seine medizinischen Eigenschaften zustande kommen. Denn KLH stimuliert im menschlichen Köprer das Immunsystem wie wenig andere Substanzen, weshalb es zum Beispiel bei Immuntherapien gegen Krebs eingesetzt wird, um eine Antwort des Körpers zu provozieren.
| Mehr auf biotechnologie.de |
Wochenrückblick: Chemie-Nobelpreis an drei Ribosomen-Strukturaufklärer News: Schutzengel für Eiweiße in 3D nachgebaut Menschen: Christoph Cremer - Pionier der modernen Mikroskopie |
Von den acht Bausteinen des KLH sind sich sieben recht ähnlich. Sie bestehen jeweils aus etwa 420 Aminosäuren und ihre molekulare Struktur war bereits gut bekannt. Mit einer innovativen Methode, der 3D-Elektronenmikroskopie, erstellte die Arbeitsgruppe um Markl aus Tausenden elektronenmikroskopischer Bilder, die aus verschiedenen Perspketiven aufgenommen wurden, ein integriertes Computermodell des KLH. Dieses war detailliert genug, um wie in einem dreidimensionalen Puzzle die sieben bekannten Bausteine des KLH einpassen zu können – jeden Baustein 20 Mal. Damit war das gesamte KLH-Molekül aufgeklärt, außer dem Kragen, der den Zylinder auf beiden Seiten abschließt. Jeder dieser Kragen besteht aus zehn Kopien des achten Baussteins.
Der achte Baustein besitzt 100 Aminosäuren mehr, also insgesamt 520, und war in seiner Struktur noch ein völliges Rätsel, das die Forscher um Markl mit der 3D-Elektronenmikroskopie nicht restlos lösen konnten. Hier half Elmar Jaenicke vom Institut für Molekulare Biophysik, ein Spezialist für Röntgenstrukturanalyse. „Nur die Röntgenstrukturanalyse kann in diesem Fall eine Auflösung bis zu den einzelnen Atomen hinunter bieten“, sagt Jaenicke. Diese Kombinationstechnik hatte auch zur Aufklärung der Ribosomen-Struktur geführt, wofür ihre Entdecker 2009 den Chemie-Nobelpreis erhielten (mehr...).
Ozeantanker in Parklücke hineinbugsieren
Ein Eiweiß kann nicht so einfach geröntgt werden wie ein Schienbein. Zunächst muss es in einen Kristall verwandelt werden. In einen derart starren Gitterrahmen würde ein Proteinmolekül natürlicherweise nie einnehmen. Bei KLH gab es zusätzliche Schwierigkeiten. „Ein so großes Protein wie das gesamte KLH in einen Kristall einzubauen, ist nahezu unmöglich. Auch bei den viel kleineren Bausteinen des KLH ist es so, als ob man einen Ozeantanker in eine Parklücke hineinmanövrieren wollte; es dauert wochenlang“, beschreibt Jaenicke den Prozess, bei dem die Proteine unter Zugabe von Salz aus der Lösung ganz allmählich ausflocken.
Dabei müssen alle Parameter wie Konzentration der Lösungen oder die Temperatur genau stimmen. „Die richtigen Bedingungen beim Kragenbaustein herauszufinden, hat Monate gedauert“, sagt Jaenicke. „Zuvor musste der Kragenbaustein in großen Mengen von den anderen sieben Bausteinen abgetrennt werden. Das war biochemische Schwerarbeit.“ Nach der erfolgreichen Kristallisation konnte der bisher unbekannte KLH-Kragenbaustein dann geröntgt werden. Zum Vorschein kam ein Gebilde, das in seinem Vorderteil den übrigen sieben Bausteinen gleicht, aber am Hinterende ein weiteres Teil besitzt; in diesem stecken zusätzlich 100 Aminosäuren. „Die Struktur dieses Zusatzteils stimmt auf erstaunliche Weise mit Proteinen aus der Cupredoxin-Familie überein. Allerdings fehlt deren übliches Kupferatom im Zentrum“, erläutert Jaenicke. Eine Recherche in den Protein-Datenbanken ergab, dass auch im Hämocyanin von Gliederfüßern wie Krebsen und Spinnen ein Fortsatz Cupredoxin-ähnlich ist, was bisher übersehen worden war.
Fortsätze wichtig für die Stabilität des Kragens
„Die Hämocyanine von Gliederfüßern und Weichtieren sind ganz unterschiedlich aufgebaut, sodass sie aus zwei getrennten Wurzeln stammen dürften.“ Jaenicke geht nun davon aus, dass die Evolution beider Hämocyanin-Familien dennoch ähnlich verlief. „In beiden Fällen waren die Cupredoxin-ähnlichen Domänen ursprünglich wahrscheinlich wichtig für den Erhalt des Kupferzentrums. Vielleicht haben sie früher dazu beigetragen, die Kupferionen in das Hämocyanin einzubauen und so die Sauerstoffversorgung zu verbessern.“ Heute allerdings haben die Cupredoxin-ähnlichen Domänen offensichtlich vor allem die Aufgabe, die Struktur der riesigen Hämocyanin-Moleküle zu stabilisieren. Nach Einpassen des Kragenbausteins in das KLH-Modell wurde nämlich deutlich, dass der Kragen nur über den Cupredoxin-ähnlichen Zusatz zusammenhält.
Das nächste gemeinsame Ziel ist nun, auf der Basis dieses Strukturmodells den Informationsaustausch zwischen den verschiedenen Bausteinen bei der gemeinschaftlichen Sauerstoffbindung genau zu beschreiben. Bis heute ist zum Beispiel unklar, woher die verschiedenen Bereiche des Proteins „erfahren“, dass an einer Stelle ihres Moleküls Sauerstoff gebunden wurde. Jedenfalls reagieren alle Bereiche gleichzeitig und binden nun ihrerseits die Sauerstoffmoleküle besser. Die Mediziner hoffen, dass ein Verständnis dieser Prozesse erlauben würde, die medizinische Wirkung des Proteins nachzuahmen und damit noch potentere Immuntherapien zu entwickeln.